
Binaire zouten Algemene formule, nomenclatuur en voorbeelden
De binaire zouten zijn ionische soorten die algemeen bekend zijn in de chemie, geïdentificeerd als stoffen die deel uitmaken van sterke elektrolyten, vanwege hun volledige dissociatie in hun samenstellende ionen wanneer ze in een oplossing zijn.
De term "binair" verwijst naar hun vorming, aangezien ze uit slechts twee elementen bestaan: een kation van metallische oorsprong met een eenvoudig anion van niet-metallische oorsprong (anders dan zuurstof), die zijn verbonden door een ionische binding..
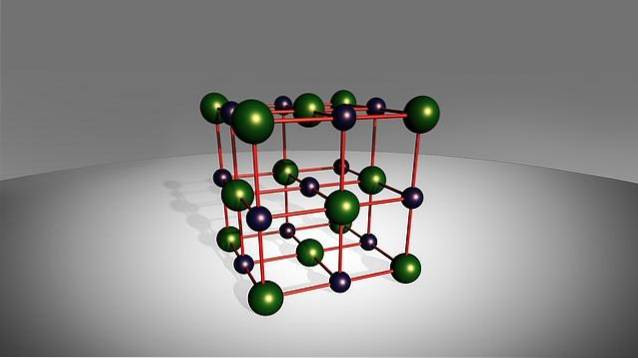
Hoewel hun naam aangeeft dat ze uit slechts twee elementen bestaan, neemt dit niet weg dat er in sommige van deze zouten meer dan één atoom van het metaal, het niet-metaal of beide soorten aanwezig kan zijn. Aan de andere kant vertonen sommige van deze soorten behoorlijk giftig gedrag, zoals natriumfluoride, NaF.
Ze kunnen ook een hoge reactiviteit vertonen bij contact met water, hoewel deze eigenschappen enorm kunnen variëren tussen chemisch zeer vergelijkbare zouten..
Artikel index
- 1 Algemene formule van binaire zouten
- 2 Nomenclatuur van binaire zouten
- 2.1 Systematische nomenclatuur
- 2.2 Voorraadnomenclatuur
- 2.3 Traditionele nomenclatuur
- 3 Hoe worden binaire zouten gevormd?
- 4 Voorbeelden van binaire zouten
- 5 referenties
Algemene formule van binaire zouten
Zoals eerder vermeld, bestaan binaire zouten uit een metaal en een niet-metalen in hun structuur, dus hun algemene formule is MmXn (waarbij M het metalen element is en X het niet-metalen element).
Op deze manier kunnen de metalen die deel uitmaken van de binaire zouten afkomstig zijn uit het "s" -blok van het periodiek systeem - alkaline (zoals natrium) en aardalkalimetaal (zoals calcium) - of uit het "p" -blok van het periodiek systeem. periodiek systeem (zoals aluminium).
Op dezelfde manier zijn onder de niet-metalen elementen waaruit dit soort chemische stoffen bestaat, die van groep 17 van het periodiek systeem, bekend als halogenen (zoals chloor), evenals andere elementen van het "p" -blok zoals zwavel of stikstof, behalve zuurstof.
Nomenclatuur van binaire zouten
Volgens de International Union of Pure and Applied Chemistry (IUPAC) kunnen drie systemen worden gebruikt om binaire zouten te benoemen: systematische nomenclatuur, voorraadnomenclatuur en traditionele nomenclatuur.
Systematische nomenclatuur
Wanneer u deze methode gebruikt, moet u beginnen met de naam van het niet-metalen, en de uitgang -uro toevoegen; in het geval van een broomzout (Br) zou het bijvoorbeeld 'bromide' worden genoemd.
Onmiddellijk na het benoemen van het niet-metaal, wordt het voorzetsel "van" geplaatst; in het vorige geval zou het "bromide of" zijn.
Ten slotte wordt het metalen element genoemd zoals het normaal wordt genoemd. Daarom, als hetzelfde voorbeeld wordt gevolgd en het is samengesteld uit kalium als het metaal, zou de verbinding worden geschreven als KBr (waarvan de structuur correct is uitgebalanceerd) en wordt het kaliumbromide genoemd..
In het geval dat de stoichiometrie van het zout verschilt van de 1: 1-combinatie, wordt elk element genoemd met een voorvoegsel dat het subscript aangeeft of het aantal keren dat elk element wordt gevonden.
Bijvoorbeeld de combinatieverhouding in het CaCl-zouttwee het is 1: 2 (voor elk calciumatoom zijn er twee chloor), dus het wordt genoemd als calciumdichloride; gebeurt op dezelfde manier met de andere verbindingen.
Voorraadnomenclatuur
Wanneer u deze procedure gebruikt, begint u met het benoemen van de verbinding op een zeer vergelijkbare manier als hoe het wordt gedaan in de systematische nomenclatuur, maar zonder een voorvoegsel van een component van de stof..
In dit geval wordt alleen rekening gehouden met het oxidatiegetal van het metalen element (de absolute waarde in alle gevallen).
Om het binaire zout een naam te geven, plaatst u het valentie-nummer in de Romeinse notatie tussen haakjes, achter de soortnaam. FeCl kan als voorbeeld worden gegeventwee dat volgens deze regels ijzer (II) chloride wordt genoemd.
Traditionele nomenclatuur
Wanneer de normen van de traditionele nomenclatuur worden gevolgd, wordt in plaats van een voorvoegsel aan het anion of kation van het zout toe te voegen of expliciet het valentienummer van het metaal te plaatsen, eerder een achtervoegsel geplaatst, afhankelijk van de oxidatietoestand van het metaal..
Om deze methode te gebruiken, wordt het niet-metaal op dezelfde manier genoemd als in de voorraadmethode en als er een zout aanwezig is waarvan de elementen meer dan één oxidatiegetal hebben, moet het een naam krijgen met een achtervoegsel dat dit aangeeft..
Als het metalen element het laagste oxidatiegetal gebruikt, wordt het achtervoegsel "beer" toegevoegd; Als u daarentegen het hoogste valentiegetal gebruikt, wordt het achtervoegsel "ico" toegevoegd..
Een voorbeeld hiervan kan de verbinding FeCl zijn3, dat ‘ferrichloride’ wordt genoemd omdat ijzer zijn maximale valentie gebruikt (3). In het zoute FeCltwee, waarin ijzer zijn laagste valentie gebruikt (2), wordt de naam ferrochloride gebruikt. Het gebeurt op een vergelijkbare manier met de rest.
Hoe worden binaire zouten gevormd?
Zoals eerder vermeld, worden deze meestal neutrale stoffen gevormd door de combinatie door middel van een ionische binding van een metallisch element (zoals die van groep 1 van het periodiek systeem) en een niet-metallische soort (zoals die van groep 17 van het periodiek systeem). het periodiek systeem), behalve zuurstof- of waterstofatomen.
Op dezelfde manier is het gebruikelijk om te ontdekken dat bij chemische reacties waarbij binaire zouten betrokken zijn, er warmte vrijkomt, wat betekent dat het een exotherme reactie is. Daarnaast zijn er verschillende risico's afhankelijk van het zout waarmee het wordt behandeld.
Voorbeelden van binaire zouten
Hieronder staan enkele binaire zouten samen met hun verschillende namen, afhankelijk van de gebruikte nomenclatuur:
NaCl
- Natriumchloride (traditionele nomenclatuur)
- Natriumchloride (voorraadnomenclatuur)
- Natriummonochloride (systematische nomenclatuur)
BaCltwee
- Bariumchloride (traditionele nomenclatuur)
- Bariumchloride (voorraadnomenclatuur)
- Bariumdichloride (systematische nomenclatuur)
CoS
- Kobaltsulfide (raditionele nomenclatuur)
- Kobalt (II) sulfide (voorraadnomenclatuur)
- Kobaltmonosulfide (systematische nomenclatuur)
CotweeS3
- Kobalt sulfide (traditionele nomenclatuur)
- Kobalt (III) sulfide (voorraadnomenclatuur)
- Dicobalttrisulfide (systematische nomenclatuur)
Referenties
- Wikipedia. (s.f.). Binaire fase. Opgehaald van en.wikipedia.org
- Chang, R. (2007). Chemistry, negende editie (McGraw-Hill).
- Levy, J. M. (2002). Hazmat Chemistry Study Guide, Second Edition. Opgehaald van books.google.co.ve
- Burke, R. (2013). Chemie van gevaarlijke materialen voor noodhulpverleners, derde editie. Opgehaald van books.google.co.ve
- Franzosini, P. en Sanesi, M. (2013). Thermodynamische en transporteigenschappen van organische zouten. Opgehaald van books.google.co.ve


Niemand heeft nog op dit artikel gereageerd.