
Kaliumsulfaat (K2SO4) structuur, eigenschappen, gebruik, synthese

De kaliumsulfaat is een wit of kleurloos anorganisch zout waarvan de chemische formule K istweeSW4. Het was al in de veertiende eeuw bekend en werd in de zeventiende eeuw zout duplicatum genoemd, omdat het een combinatie is van een zuur zout en een alkalisch zout..
Kaliumsulfaat komt in minerale vorm voor in arcaniet, maar de presentatie ervan komt vaker voor in de zogenaamde Stassfurt-zouten. Dit zijn co-kristallisaties van kalium-, magnesium-, calcium- en natriumsulfaten, waarneembaar in mineralen zoals leoniet en polyhaliet..

Kaliumsulfaat is een weinig giftig zout en veroorzaakt alleen irritatie bij contact met de ogen, de luchtwegen of het spijsverteringskanaal. Er zijn geen aanwijzingen voor een carcinogene of mutagene werking.
Kaliumsulfaat wordt gebruikt als meststof, vooral in gewassen die gevoelig zijn voor chloriden; dat is het geval bij tabak en aardappelen. De verbinding levert kalium, een van de drie belangrijkste voedingsstoffen in planten, en zwavel, dat aanwezig is in hun eiwitten..
Artikel index
- 1 Structuur
- 1.1 Kristallijne fasen
- 1.2 Ionenverwarring
- 2 Fysische en chemische eigenschappen
- 2.1 Namen
- 2.2 Molaire massa
- 2.3 Fysiek uiterlijk
- 2.4 Dichtheid
- 2.5 Smeltpunt
- 2.6 Kookpunt
- 2.7 Oplosbaarheid in water
- 2.8 Oplosbaarheid in organische oplosmiddelen
- 2.9 Brekingsindex (nD)
- 2.10 Reactiviteit
- 3 Synthese
- 3.1 Eerste methode
- 3.2 Tweede methode
- 3.3 Derde methode
- 3.4 Vierde methode
- 4 toepassingen
- 4.1 Meststof
- 4.2 Industrieel gebruik en als grondstof
- 4.3 Geneeskunde
- 4.4 Veterinair
- 4.5 Voedselaroma
- 4.6 Andere toepassingen
- 5 Risico's
- 6 referenties
Structuur
Kristallijne fasen
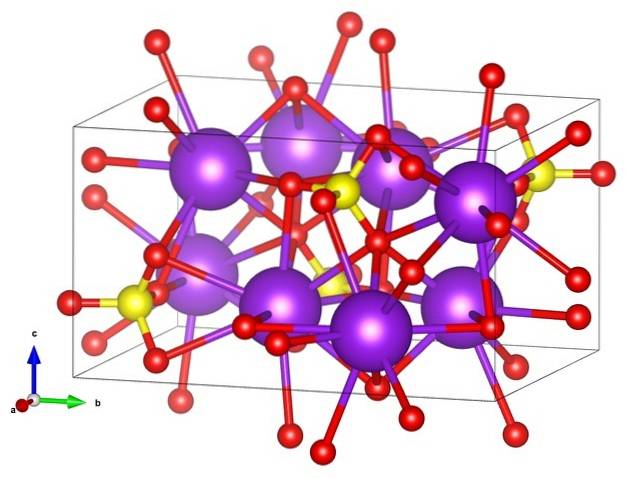
In de eerste afbeelding werd de structuurformule van kaliumsulfaat getoond. Voor elk SO-anion4twee-, van tetraëdrische geometrie, zijn er twee kationen K+, die kan worden weergegeven door paarse bollen (bovenste afbeelding).
Dus hierboven hebben we de orthorhombische kristalstructuur van KtweeSW4, met SO anionen4twee- vertegenwoordigd door gele en rode bollen; terwijl de K kationen+, al gezegd, het zijn de paarse bollen (iets robuuster).
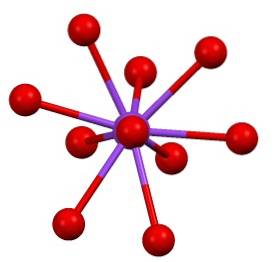
Deze weergave kan verwarring veroorzaken als u denkt dat de balken echt overeenkomen met coördinatieverbindingen. Ze geven eerder aan welk ion direct of nauw samenwerkt met een ander eromheen. Daarom "verbindt" elke zuurstof zich met vijf K+ (OF3SWtwee-- K+), en deze op hun beurt met tien zuurstofatomen uit andere omringende sulfaatanionen.
Er is dan een ietwat "zeldzame" coördinatiesfeer voor kalium in KtweeSW4
Deze kristallijne structuur komt overeen met polymorf β-KtweeSW4. Bij verhitting tot 583 ºC treedt een overgang op naar de α-K fasetweeSW4, dat is zeshoekig.
Ion wirwar
Zeker de structuur van KtweeSW4 het is ongebruikelijk gecompliceerd voor een anorganisch zout. De ionen zijn gepositioneerd en vormen een soort zinloze verwarring en missen met het blote oog periodiciteit.
Degenen die zich toeleggen op kristallografie, kunnen deze kluwen op een meer gepaste en beschrijvende manier benaderen, gezien vanuit de drie ruimtelijke assen..
Merk op dat de verwarde structuur zou kunnen verklaren waarom de KtweeSW4 vormt geen hydraten: H-moleculentweeOf ze kunnen het kristalrooster niet binnendringen om kaliumkationen te hydrateren.
Bovendien is het te verwachten, met zoveel interacties in de ionenwirwar, dat dit kristalrooster een behoorlijke stabiliteit tegen hitte zal hebben; en in feite is dit het geval, aangezien het smeltpunt van KtweeSW4 is 1.069 ºC, wat aantoont dat de ionen sterk samenhangend zijn.
Fysische en chemische eigenschappen

Namen
-Kaliumsulfaat
-Kaliumsulfaat
-Arcanite
-Zwavel potas
Molaire massa
174,259 g / mol
Fysiek uiterlijk
Witte, geurloze, bitter smakende kristalvaste stof, korrels of poeder.
Dichtheid
2,66 g / cm3
Smeltpunt
1.069 ºC
Kookpunt
1.689 ºC
Oplosbaarheid in water
111 g / L bij 20 ºC
120 g / L bij 25 ºC
240 g / L bij 100 ºC
De oplosbaarheid in water neemt af door de aanwezigheid van kaliumchloride, KCl of ammoniumsulfaat (NH4tweeSW4, vanwege het gewone ioneneffect.
Oplosbaarheid in organische oplosmiddelen
Enigszins oplosbaar in glycerol, maar onoplosbaar in aceton en koolstofsulfide.
Brekingsindex (nD)
1.495
Reactiviteit
Kaliumsulfaat kan reageren met zwavelzuur, verzuren tot kaliumbisulfaat (KHSO4Het kan bij hoge temperaturen worden gereduceerd tot kaliumsulfide (KtweeS).
Synthese
Eerste methode
Kaliumsulfaat wordt gesynthetiseerd door kaliumchloride te laten reageren met zwavelzuur. De synthese van kaliumsulfaat vindt plaats in twee stappen. De eerste stap omvat de vorming van kaliumbisulfaat.
Dit is een exotherme reactie omdat het warmte afgeeft en daarom geen externe warmtetoevoer nodig heeft. De reactie wordt uitgevoerd bij kamertemperatuur.
KCl + HtweeSW4 => HCl + KHSO4
De tweede stap van de reactie is endotherm, dat wil zeggen dat er warmte moet worden toegevoerd zodat deze kan plaatsvinden.
KCl + KHSO4 => HCl + KtweeSW4
Tweede methode
Kaliumsulfaat kan worden gesynthetiseerd door de neutralisatiereactie van zwavelzuur met een base, kaliumhydroxide:
H.tweeSW4 + 2 KOH => KtweeSW4 + 2 uurtweeOF
Derde methode
Kaliumsulfaat wordt geproduceerd door de reactie van zwaveldioxide, zuurstof, kaliumchloride en water.
Vierde methode
Kaliumsulfaat wordt geproduceerd door het kaliumsulfaat te extraheren dat aanwezig is in een pekel uit het Loop Nur-bassin, China. Kaliumsulfaat wordt gescheiden van de onoplosbare componenten van de pekel door toevoeging van de verzurende verbinding natriumtripolyfosfaat / ureumfosfaat.
Deze verbinding vergroot het verschil tussen de oplosbaarheid van kaliumsulfaat en de oplosbaarheid van de andere minder oplosbare verbindingen, waardoor volgens de makers van de methode een 100% zuiver kaliumsulfaat wordt verkregen. Strikt genomen is het geen synthesemethode, maar een nieuwe extractiemethode.
Toepassingen
Kunstmest

Het gebruik van kaliumsulfaat als meststof is de belangrijkste toepassing ervan. Hiervoor wordt 90% van de totale productie gebruikt. Het gebruik ervan heeft de voorkeur boven dat van kaliumchloride in die gewassen die gevoelig zijn voor de aanwezigheid van chloride in de bodem; bijvoorbeeld tabak.
Kaliumsulfaat heeft een kaliumgehalte van 40-44%, terwijl de zwavelconcentratie 17-18% van de verbinding vertegenwoordigt. Kalium is nodig om veel essentiële functies voor planten te vervullen, omdat het enzymatische reacties, eiwitsynthese, zetmeelvorming, enz. Activeert..
Bovendien is kalium betrokken bij het reguleren van de waterstroom in de bladeren. Zwavel is nodig voor eiwitsynthese, omdat het aanwezig is in aminozuren die het bezitten; dat is het geval met methionine, cysteïne en cystine, en het grijpt ook in bij enzymatische reacties.
Zelfs kaliumsulfaat wordt gebruikt door op de bladeren te sproeien in kaliumsulfaatdeeltjes kleiner dan 0,015 mm.
Industrieel gebruik en als grondstof
Ruw kaliumsulfaat wordt gebruikt bij de vervaardiging van glas en bij de vervaardiging van aluin en kaliumcarbonaat. Het wordt gebruikt als reagens bij de vervaardiging van cosmetica. Het wordt gebruikt bij de bereiding van bier als watercorrectiemiddel.
Geneesmiddel
Het wordt gebruikt om een ernstige afname van de plasmakaliumconcentratie (hypokaliëmie) te corrigeren, veroorzaakt door overmatig gebruik van diuretica die de uitscheiding van kalium via de urine verhogen..
Kalium is het belangrijkste intracellulaire ion van prikkelbare cellen, inclusief hartcellen. Daarom brengt een ernstige afname van kalium in plasma de hartfunctie in gevaar en moet deze onmiddellijk worden gecorrigeerd..
Kaliumsulfaat heeft een cathartische werking, dat wil zeggen, het bevordert de uitdrijving van ontlasting uit de dikke darm. Om deze reden wordt een mengsel van kalium-, magnesium- en natriumsulfaten gebruikt om de ontlasting uit de dikke darm te verwijderen voordat een colonoscopie wordt uitgevoerd, waardoor de arts een betere visualisatie van de dikke darm mogelijk maakt..
dierenarts
Kaliumsulfaat is gebruikt om de methioninebehoefte in pluimveevoer te verminderen. De aanwezigheid van 0,1% kaliumsulfaat in het voer van legkippen gaat gepaard met een toename van 5% in de eierproductie.
Voedselaroma
Het is een smaakstof die voedingsmiddelen een bittere en zoute smaak geeft die bij sommigen wenselijk is. Bovendien wordt opgemerkt dat kaliumsulfaat is begiftigd met de vier basissmaken: zoetheid, bitterheid, zuurgraad en zoutgehalte..
Het zoutgehalte, de zuurgraad en de bitterheid nemen toe met de concentratie van kaliumsulfaat, terwijl de zoetheid afneemt.
Andere gebruiken
Kaliumsulfaat wordt gebruikt als pyrotechnisch middel, in combinatie met kaliumnitraat, om een paarse vlam te genereren. Gebruikt als een flitsreductiemiddel in artillerie-thrusterladingen.
Bovendien wordt het gebruikt als viscositeitsverhogend middel in cosmetische producten zoals gezichtscrèmes..
Risico's
Kaliumsulfaat is een laag-giftige verbinding met een zeer lage letaliteit. De LD50 voor de orale dosis bij muizen is 6600 mg / kg dierlijk gewicht, wat aangeeft dat een hoge dosis nodig is om de dood van de muis te veroorzaken. Dezelfde LD50-waarde komt voor bij ratten.
In de ogen kan kaliumsulfaat bij contact mechanische irritatie veroorzaken. Op de huid veroorzaakt kaliumsulfaat weinig schade bij industriële hantering..
Bij inslikken kan kaliumsulfaat gastro-intestinale irritatie veroorzaken met misselijkheid, braken en diarree. En tot slot veroorzaakt inademing van kaliumsulfaatstof irritatie van de luchtwegen..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Kaliumsulfaat. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Kaliumsulfaat. PubChem-database. CID = 24507. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5 juli 2018). Kaliumsulfaat. Royal Society of Chemistry. Hersteld van: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (1996). Onderwerpen in fosfaatchemie. Wereld Wetenschappelijk. Hersteld van: books.google.co.ve
- Chemisch boek. (2017). Kaliumsulfaat. Hersteld van: chemicalbook.com
- Shoujiang L. et al. (2019). Zuivering en snelle oplossing van kaliumsulfaat in waterige oplossingen. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Kaliumsulfaat. Hersteld van: drugbank.ca
- The Mosaic Company. (2019). Kaliumsulfaat. Gewasvoeding. Hersteld van: cropnutrition.com
- Drugs. (2018). Natriumsulfaat, kaliumsulfaat en magnesiumsulfaat (oraal). Hersteld van: drugs.com



Niemand heeft nog op dit artikel gereageerd.