
Triethylamine structuur, eigenschappen, toepassingen en risico's
De triethylamine is een organische verbinding, meer bepaald een alifatisch amine, waarvan de chemische formule N (CHtweeCH33 of NEt3. Net als andere vloeibare aminen heeft het een geur die lijkt op die van ammoniak vermengd met vis; de dampen maken het vervelend en gevaarlijk om met deze stof om te gaan zonder afzuigkap of geschikte kleding.
Naast hun respectievelijke formules wordt deze verbinding vaak afgekort als TEA; dit kan echter tot verwarring leiden met andere aminen, zoals triethanolamine, N (EtOH)3, of tetraethylammonium, een quaternair amine, NEt4+.

Uit het skelet (bovenste afbeelding) kan worden gezegd dat triethylamine veel lijkt op ammoniak; terwijl de tweede drie waterstofatomen heeft, NH3, de eerste heeft drie ethylgroepen, N (CHtweeCH33. De synthese begint bij de behandeling van vloeibare ammoniak met ethanol, waarbij een alkylering plaatsvindt.
Het net3 kan een hygroscopisch zout vormen met HCl: triethylamine hydrochloride, NEt3· HCl. Daarnaast neemt het als homogene katalysator deel aan de synthese van esters en amiden, waardoor het een noodzakelijk oplosmiddel is in organische laboratoria..
Samen met andere reagentia maakt het ook de oxidatie van primaire en secundaire alcoholen tot respectievelijk aldehyden en ketonen mogelijk. Ammoniak is net als een base en kan daarom door neutralisatiereacties organische zouten vormen.
Artikel index
- 1 Structuur van triethylamine
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molaire massa
- 2.3 Kookpunt
- 2.4 Smeltpunt
- 2.5 Dichtheid
- 2.6 Oplosbaarheid
- 2.7 Dampdichtheid
- 2.8 Dampspanning
- 2.9 Henry's constante
- 2.10 Vlampunt
- 2.11 Zelfontbrandingstemperatuur
- 2.12 Warmtecapaciteit
- 2.13 Verbrandingswarmte
- 2.14 Verdampingswarmte
- 2.15 Oppervlaktespanning
- 2.16 Brekingsindex
- 2.17 Viscositeit
- 2.18 Basiciteitsconstante
- 2.19 Basiciteit
- 3 toepassingen
- 3.1 Polymeren
- 3.2 Chromatografie
- 3.3 Commerciële producten
- 4 Risico's
- 5 referenties
Structuur van triethylamine
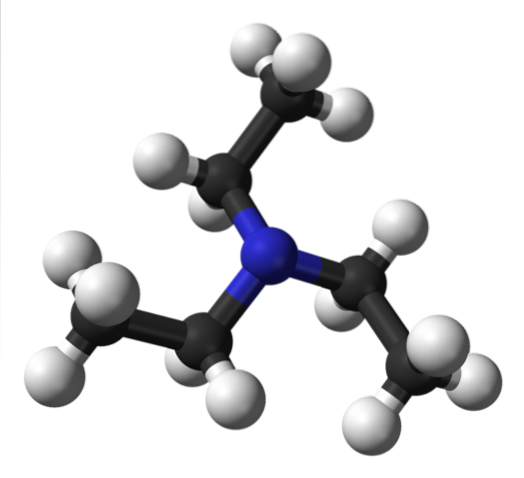
De bovenste afbeelding toont de structuur van triethylamine met een model van bollen en staven. In het midden van het molecuul bevindt zich het stikstofatoom, voorgesteld door een blauwachtige bol; en daarmee verbonden, de drie ethylgroepen, als kleine takken van zwarte en witte bollen.
Hoewel ze met het blote oog niet zichtbaar zijn, bevindt zich op het stikstofatoom een paar niet-gedeelde elektronen. Deze twee elektronen en de drie -CH-groepentweeCH3 ze ervaren elektronische afstotingen; maar aan de andere kant dragen ze bij aan het bepalen van het dipoolmoment van het molecuul.
Zo'n dipoolmoment is echter kleiner dan dat van bijvoorbeeld diethylamine, NHEttweeen evenzo mist het elke mogelijkheid om waterstofbruggen te vormen.
Dit komt omdat er in triethylamine geen N-H-binding is en bijgevolg lagere smelt- en kookpunten worden waargenomen in vergelijking met andere aminen die wel op een dergelijke manier met elkaar in wisselwerking staan..
Hoewel er een klein dipoolmoment is, kunnen de dispersiekrachten tussen de ethylgroepen van NEt-moleculen niet worden uitgesloten.3 buren. Als we dit effect bij elkaar optellen, is het gerechtvaardigd dat triethylamine, hoewel het vluchtig is, kookt bij ongeveer 89 ºC, dankzij de relatief grote molecuulmassa..
Eigendommen
Fysiek uiterlijk
Kleurloze vloeistof met onaangename ammoniak- en visgeur.
Molaire massa
101.193 g / mol.
Kookpunt
89ºC.
Smeltpunt
-115 ° C. Merk op hoe zwak de intermoleculaire krachten zijn die de triethylaminemoleculen in hun vaste stof binden.
Dichtheid
0,7255 g / ml.
Oplosbaarheid
Het is relatief oplosbaar in water, 5,5 g / 100 g bij 20 ° C. Beneden de 18,7 ºC is het volgens Pubchem zelfs hiermee mengbaar.
Naast het "opschieten" met water, is het ook oplosbaar in aceton, benzeen, ethanol, ether en paraffine..
Dampdichtheid
3,49 in luchtverhouding.
Dampdruk
57,07 mmHg bij 25ºC.
Henry is constant
66 μmol / Pa Kg.
ontstekingspunt
-15ºC.
Zelfontbranding temperatuur
312 ° C.
Warmte capaciteit
216,43 kJ / mol.
Verbrandingswarmte
10.248 cal / g.
Warmte van verdamping
34,84 kJ / mol.
Oppervlaktespanning
20,22 N / m bij 25 ° C.
Brekingsindex
1.400 bij 20ºC.
Viscositeit
0,347 mPa.s bij 25 ° C.
Basiciteitsconstante
Triethylamine heeft een pKb gelijk aan 3,25.
Basiciteit
De basiciteit van dit amine kan worden uitgedrukt door de volgende chemische vergelijking:
Netto3 + HA <=> NHEt3+ + NAAR-
Waar HA een zwak zure soort is. Het NHEt-paar3+NAAR- vormt wat een tertiair ammoniumzout wordt.
Geconjugeerd zuur NHEt3+ is stabieler dan ammonium, NH4+, omdat de drie ethylgroepen een deel van hun elektronendichtheid afstaan om de positieve lading op het stikstofatoom te verminderen; daarom is triethylamine basischer dan ammoniak (maar minder basisch dan OH-.
Toepassingen

De basiciteit, in dit geval de nucleofiliciteit van triethylamine, wordt gebruikt om de synthese van ester en amiden uit een gemeenschappelijk substraat te katalyseren: een acylchloride, RCOCl (bovenste afbeelding).
Hier valt het vrije elektronenpaar uit stikstof de carbonylgroep aan en vormt een tussenproduct; die achtereenvolgens wordt aangevallen door een alcohol of een amine om respectievelijk een ester of amide te vormen.
In de eerste rij van het beeld wordt het mechanisme gevisualiseerd dat wordt gevolgd door de reactie om de ester te produceren, terwijl de tweede rij overeenkomt met het amide. Merk op dat triethylaminehydrochloride, NEt, in beide reacties wordt geproduceerd3HCl, waaruit de katalysator wordt gewonnen om een nieuwe cyclus te starten.
Polymeren
De nucleofiliciteit van triethylamine wordt ook gebruikt om aan bepaalde polymeren toe te voegen, ze uit te harden en ze een grotere massa te geven. Het maakt bijvoorbeeld deel uit van de synthese van polycarbonaatharsen, polyurethaanschuimen en epoxyharsen.
Chromatografie
Door zijn verre amfifiliciteit en vluchtigheid kunnen de daarvan afgeleide zouten worden gebruikt als reagentia bij ionenuitwisselingschromatografie. Een ander impliciet gebruik van triethylamine is dat er verschillende tertiaire aminezouten uit kunnen worden verkregen, zoals triethylaminebicarbonaat, NHEt3HCO3 (of TEAB).
Commerciële producten
Het is gebruikt als additief bij de formulering van sigaretten en tabak, conserveringsmiddelen voor levensmiddelen, vloerreinigers, smaakstoffen, pesticiden, kleurstoffen, enz..
Risico's
Triethylaminedampen zijn niet alleen onaangenaam maar ook gevaarlijk, omdat ze de neus, keel en longen kunnen irriteren, wat kan leiden tot longoedeem of bronchitis. Evenzo, omdat ze dichter en zwaarder zijn dan lucht, blijven ze gelijk met de grond en gaan ze naar mogelijke warmtebronnen om later te exploderen..
Houders met deze vloeistof moeten zo ver mogelijk van het vuur verwijderd zijn, omdat ze een onmiddellijk explosiegevaar vormen..
Bovendien moet het contact met soorten of reagentia zoals: alkalimetalen, trichloorazijnzuur, nitraten, salpeterzuur (aangezien het nitrosoaminen, kankerverwekkende verbindingen zou vormen), sterke zuren, peroxiden en permanganaten worden vermeden..
Het mag aluminium, koper, zink of hun legeringen niet aanraken, aangezien het deze kan corroderen.
Met betrekking tot lichamelijk contact kan het allergieën en huiduitslag veroorzaken als de blootstelling acuut is. Naast de longen kan het ook de lever en de nieren aantasten. En wat betreft oogcontact, het veroorzaakt irritatie, die zelfs de ogen kan beschadigen als ze niet op tijd worden behandeld of schoongemaakt..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Wikipedia. (2019). Triethylamine. Hersteld van: en.wikipedia.org
- Merck. (2019). Triethylamine. Hersteld van: sigmaaldrich.com
- Nationaal centrum voor informatie over biotechnologie. (2019). Triethylamine. PubChem-database. CID = 8471. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Toxicologie Datanetwerk. (s.f.). Triethylamine. Hersteld van: toxnet.nlm.nih.gov
- Ministerie van Volksgezondheid van New Jersey. (2010). Triethylamine. Hersteld van: nj.gov



Niemand heeft nog op dit artikel gereageerd.