
Trinitrotolueen (TNT) structuur, eigenschappen, gebruik, risico's, explosie
De trinitrotolueen is een organische verbinding die bestaat uit koolstof, zuurstof, waterstof en stikstof met drie nitro-NO-groepentwee. De chemische formule is C6H.twee(CH3)(NIETtwee3 of ook de gecondenseerde formule C7H.5N3OF6.
De volledige naam is 2,4,6-trinitrotolueen, maar het is algemeen bekend als TNT. Het is een witte kristallijne vaste stof die kan exploderen bij verhitting boven een bepaalde temperatuur.

De aanwezigheid in trinitrotolueen van de drie nitro-NO-groepentwee is voorstander van het feit dat het met enig gemak explodeert. Om deze reden is het op grote schaal gebruikt in explosieven, projectielen, bommen en granaten..
Het is ook gebruikt voor explosies onder water, in diepe putten en voor industriële of niet-oorlogsexplosies..
TNT is een delicaat product dat ook kan exploderen door zeer harde slagen. Het is ook giftig voor mens, dier en plant. De plaatsen waar hun explosies hebben plaatsgevonden, zijn besmet en er wordt onderzoek gedaan om de overblijfselen van deze compound te verwijderen.
Een manier die effectief en goedkoop kan zijn om de concentratie TNT in de vervuilde omgeving te verlagen, is door het gebruik van bepaalde soorten bacteriën en schimmels..
Artikel index
- 1 Chemische structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Vlampunt
- 3.6 Dichtheid
- 3.7 Oplosbaarheid
- 3.8 Chemische eigenschappen
- 4 Explosieproces van TNT
- 4.1 Oxidatiereactie van TNT
- 5 TNT verkrijgen
- 6 Gebruik van TNT
- 6.1 Bij militaire activiteiten
- 6.2 In industriële toepassingen
- 7 Risico's van TNT
- 8 Vervuiling van het milieu met TNT
- 8.1 Oplossing voor TNT-besmetting
- 8.2 Sanering met bacteriën en schimmels
- 8.3 Sanering met algen
- 9 referenties
Chemische structuur
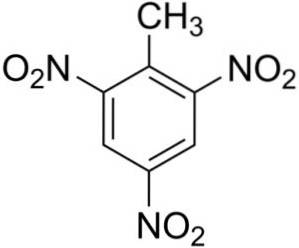
2,4,6-Trinitrotolueen bestaat uit één molecuul tolueen C6H.5-CH3, waaraan drie nitro-NO-groepen zijn toegevoegdtwee.
De drie nitro-NO-groepentwee ze zijn symmetrisch gelegen op de benzeenring van tolueen. Ze zijn te vinden op posities 2, 4 en 6, waar positie 1 overeenkomt met methyl -CH3.
Nomenclatuur
- Trinitrotolueen
- 2,4,6-trinitrotolueen
- TNT
- Trilite
- 2-methyl-1,3,5-trinitrobenzeen
Eigendommen
Fysieke toestand
Kleurloze tot lichtgele kristallijne vaste stof. Naaldvormige kristallen.
Molecuulgewicht
227,13 g / mol.
Smeltpunt
80,5 ºC.
Kookpunt
Het kookt niet. Ontleedt met een explosie bij 240 ºC.
Vlampunt
Het is niet te meten omdat het explodeert.
Dichtheid
1,65 g / cm3
Oplosbaarheid
Bijna onoplosbaar in water: 115 mg / L bij 23 ° C. Zeer slecht oplosbaar in ethanol. Zeer goed oplosbaar in aceton, pyridine, benzeen en tolueen.
Chemische eigenschappen
Kan bij verhitting explosief ontleden. Bij het bereiken van 240 ° C explodeert het. Het kan ook exploderen bij zeer sterke slagen.
Bij verhitting tot ontbinding produceert het giftige gassen van stikstofoxiden NOX.
TNT-explosieproces
De explosie van TNT leidt tot een chemische reactie. In feite is het een verbrandingsproces waarbij energie zeer snel vrijkomt. Bovendien worden gassen uitgestoten die middelen zijn om energie over te dragen.

Brandstof en oxidatiemiddel moeten aanwezig zijn om een verbrandingsreactie (oxidatie) te laten plaatsvinden.
In het geval van TNT zitten beide in hetzelfde molecuul, aangezien de koolstofatomen (C) en waterstofatomen (H) de brandstoffen zijn en het oxidatiemiddel de zuurstof (O) van de nitro-NO-groepen is.twee. Hierdoor kan de reactie sneller zijn.
TNT-oxidatiereactie
Tijdens de verbrandingsreactie van TNT herschikken de atomen zich en blijft zuurstof (O) dichter bij koolstof (C). Bovendien bevat de stikstof van -NOtwee wordt gereduceerd tot stikstofgas Ntwee wat een veel stabielere verbinding is.
De explosieve chemische reactie van TNT kan als volgt worden samengevat:
2 C7H.5N3OF6 → 7 CO ↑ + 7 C + 5 HtweeO ↑ + 3 Ntwee
Koolstof (C) wordt geproduceerd tijdens de explosie, in de vorm van een zwarte wolk, en er wordt ook koolmonoxide (CO) gevormd, wat komt doordat er niet genoeg zuurstof in het molecuul zit om alle koolstofatomen (C) en waterstof (H) aanwezig.
TNT verkrijgen
TNT is een verbinding die alleen kunstmatig door de mens wordt gemaakt.
Het komt van nature niet voor in het milieu. Komt alleen voor bij sommige militaire installaties.
Het wordt bereid door nitratie van tolueen (C.6H.5-CH3) met een mengsel van salpeterzuur HNO3 en zwavelzuur HtweeSW4. Eerst krijg je een mix van ortho- Y om zo te-nitrotolueen die door daaropvolgende energetische nitratie het symmetrische trinitrotolueen vormen.
Maakt gebruik van TNT
Bij militaire activiteiten
TNT is een explosief dat is gebruikt in oorlogszuchtige apparaten en militaire explosies.
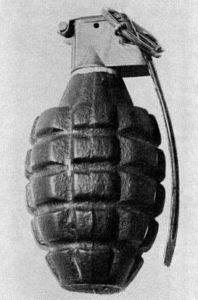
Het wordt gebruikt om projectielen, granaten en luchtbommen te vullen, omdat het ongevoelig genoeg is voor de impact om de loop van een wapen te verlaten, maar het kan exploderen wanneer het wordt geraakt door een ontstekingsmechanisme..

Niet ontworpen om aanzienlijke fragmentatie te produceren of projectielen te lanceren.
In industriële toepassingen
Het is gebruikt voor explosies van industrieel belang, onder waterstralen (vanwege zijn onoplosbaarheid in water) en diepe putexplosies. In het verleden werd het het meest gebruikt voor sloopwerkzaamheden. Het wordt momenteel samen met andere verbindingen gebruikt.

Het was ook een tussenpersoon voor kleurstoffen en fotografische chemicaliën.
Risico's van TNT
Kan ontploffen bij blootstelling aan intense hitte, vuur of zeer sterke schokken.
Het is irriterend voor de ogen, huid en luchtwegen. Het is een zeer giftige stof voor zowel mensen als dieren, planten en vele micro-organismen..
Symptomen van blootstelling aan TNT zijn onder meer hoofdpijn, zwakte, bloedarmoede, toxische hepatitis, cyanose, dermatitis, leverschade, conjunctivitis, slechte eetlust, misselijkheid, braken, diarree, onder andere..
Het is een mutageen, dat wil zeggen dat het de genetische informatie (DNA) van een organisme kan veranderen en veranderingen kan veroorzaken die verband kunnen houden met het verschijnen van erfelijke ziekten..
Het is ook geclassificeerd als kankerverwekkend of kankergenerator.
Vervuiling van het milieu met TNT
TNT is aangetroffen in bodems en wateren in gebieden van militaire oorlogsvoering, op locaties waar munitie wordt geproduceerd en waar militaire trainingsoperaties worden uitgevoerd..

Verontreiniging met TNT is gevaarlijk voor het leven van dieren, mensen en planten. Hoewel TNT momenteel in kleinere hoeveelheden wordt gebruikt, is het een van de nitro-aromatische verbindingen die het meest zijn gebruikt in de explosievenindustrie..
Om deze reden is het een van de bedrijven die het meest bijdragen aan milieuvervuiling..
Oplossing voor besmetting met TNT
De noodzaak om met TNT verontreinigde regio's te "reinigen" heeft de ontwikkeling van verschillende saneringsprocessen gemotiveerd. Sanering is het verwijderen van verontreinigende stoffen uit het milieu.
Sanering met bacteriën en schimmels
Veel micro-organismen zijn in staat TNT te bioremediëren, zoals bacteriën van het geslacht Pseudomonas, Enterobacter, Mycobacterium Y Clostridium.
Er is ook gevonden dat er bepaalde bacteriën zijn die zijn geëvolueerd op plaatsen die besmet zijn met TNT en die kunnen overleven en het ook kunnen afbreken of metaboliseren als voedingsbron..
De Escherichia coli Het heeft bijvoorbeeld een uitstekend vermogen getoond voor biotransformatie van TNT, aangezien het meerdere enzymen heeft om het aan te vallen, en tegelijkertijd een hoge tolerantie voor zijn toxiciteit vertoont..
Bovendien kunnen sommige soorten schimmels TNT biotransformeren en het in niet-schadelijke mineralen veranderen..
Algenbehandeling
Aan de andere kant hebben sommige onderzoekers ontdekt dat de alg Spirulina platensis heeft het vermogen om op het oppervlak van uw cellen te adsorberen en tot 87% van het TNT dat aanwezig is in water dat met deze verbinding is verontreinigd, te assimileren.
De tolerantie van deze alg ten opzichte van TNT en zijn vermogen om daarmee verontreinigd water te reinigen, duiden op het hoge potentieel van deze alg als fytoremediator..
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). 2,4,6-trinitrotolueen. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Murray, S.G. (2000). Explosieven. Mechanisme van explosie. In Encyclopedia of Forensic Sciences 2000, pagina's 758-764. Opgehaald van sciencedirect.com.
- Adamia, G. et al .; (2018). Over de mogelijkheid van alg Spirulina-toepassing voor fytoremediatie van water vervuild met 2,4,6-trinitrotolueen. Annals of Agrarian Science 16 (2018) 348-351. Opgehaald van reader.elsevier.com.
- Serrano-González, M.Y. et al. (2018). Biotransformatie en afbraak van 2,4,6-trinitrotolueen door microbieel metabolisme en hun interactie. Defensietechnologie 14 (2018) 151-164. Opgehaald van pdf.sciencedirectassets.com.
- Iman, M. et al. (2017). Systeembiologische benadering van bioremediatie van nitroaromaten: op beperkingen gebaseerde analyse van 2,4,6-trinitrotolueenbiotransformatie door Escherichia coli. Molecules 2017, 22, 1242. Hersteld van mdpi.com.
- Windholz, M. et al. (redactie) (1983). De Merck Index. Een encyclopedie van chemicaliën, medicijnen en biologische producten. Tiende editie. Merck & CO., Inc.
- Morrison, R.T. en Boyd, R.N. (2002). Organische chemie. 6e editie. Prentice-Hall.

Niemand heeft nog op dit artikel gereageerd.