
Zwaveltrioxide (SO3) structuur, eigenschappen, risico's, gebruik

De zwaveltrioxide Het is een anorganische verbinding die wordt gevormd door de vereniging van een zwavelatoom (S) en 3 zuurstofatomen (O). De moleculaire formule is SO3. Bij kamertemperatuur, SO3 het is een vloeistof die gassen in de lucht afgeeft.
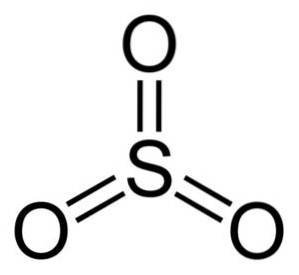
De structuur van het besturingssysteem3 gasvormig is vlak en symmetrisch. Alle drie de zuurstofatomen bevinden zich gelijk rond zwavel. De SO3 Reageert heftig met water. De reactie is exotherm, wat betekent dat er warmte wordt geproduceerd, met andere woorden, het wordt erg heet.
Toen de SO3 vloeistof koelt af, verandert in een vaste stof die drie soorten structuren kan hebben: alfa, bèta en gamma. De meest stabiele is alfa, in de vorm van met elkaar verbonden lagen die een netwerk vormen.
Gasvormig zwaveltrioxide wordt gebruikt om rokend zwavelzuur te bereiden, ook wel oleum genoemd, vanwege de gelijkenis met olie of olieachtige stoffen. Een andere belangrijke toepassing ervan is de sulfonering van organische verbindingen, dat wil zeggen de toevoeging van -SO-groepen3- naar deze. Zo kunnen bruikbare chemicaliën zoals wasmiddelen, kleurstoffen, pesticiden en vele andere worden bereid..
De SO3 Het is erg gevaarlijk, het kan ernstige brandwonden, oog- en huidletsel veroorzaken. Het mag ook niet worden ingeademd of ingeslikt, omdat het de dood kan veroorzaken door interne brandwonden, in de mond, slokdarm, maag, enz..
Om deze redenen moet er met grote voorzichtigheid mee worden omgegaan. Het mag nooit in contact komen met water of brandbare materialen zoals hout, papier, stoffen enz., Aangezien er brand kan ontstaan. Het mag ook niet worden afgevoerd en mag niet in het riool terechtkomen vanwege explosiegevaar.
De SO3 Gassen die in industriële processen worden gegenereerd, mogen niet in het milieu terechtkomen, aangezien het een van de gasvormige stoffen is die verantwoordelijk zijn voor de zure regen die al grote delen van bossen in de wereld heeft beschadigd..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Fysieke eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Tripelpunt
- 3.5 Kookpunt
- 3.6 Dichtheid
- 3.7 Dampspanning
- 3.8 Stabiliteit
- 4 Chemische eigenschappen
- 5 Verkrijgen
- 6 toepassingen
- 6.1 Bij de bereiding van oleum
- 6.2 Chemische reacties bij sulfonering
- 6.3 Bij de winning van metalen
- 6.4 In verschillende toepassingen
- 7 Risico's
- 7.1 Voor de gezondheid
- 7.2 Door brand of explosie
- 8 Milieu-impact
- 9 referenties
Structuur
Het zwaveltrioxide-molecuul SO3 in gasvormige toestand heeft het een platte driehoekige structuur.
Dit betekent dat zowel zwavel als de drie zuurstofatomen zich in hetzelfde vlak bevinden. Bovendien is de verdeling van zuurstofatomen en alle elektronen symmetrisch.
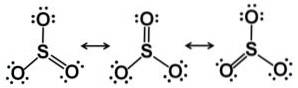
In vaste toestand zijn drie soorten structuren van de SO bekend3: alpha (α-SO3), bèta (β-SO3) en gamma (γ-SO3.
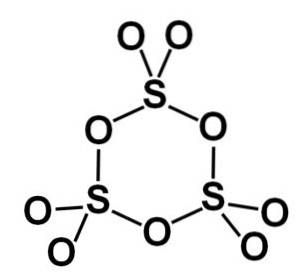
De gamma γ-SO-vorm3 bevat cyclische trimeren, dat wil zeggen drie eenheden SO3 die samen een cyclisch of ringvormig molecuul vormen.
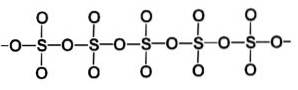
De bètafase β-SO3 bezit oneindige spiraalvormige ketens van tetraëders met samenstelling SO4 verbonden.
De meest stabiele vorm is alpha α-SO3, vergelijkbaar met bèta, maar met een gelaagde structuur, waarbij de ketens zijn samengevoegd om een netwerk te vormen.
Nomenclatuur
-Zwaveltrioxide
-Zwavelzuuranhydride
-Zwavelzuur
-SW3 gamma, γ-SO3
-SW3 beta, β-SO3
-SW3 alfa, α-SO3
Fysieke eigenschappen
Fysieke toestand
Bij kamertemperatuur (ongeveer 25 ºC) en atmosferische druk, SO3 het is een kleurloze vloeistof die dampen in de lucht afgeeft.
Toen de SO3 vloeistof is puur bij 25 ºC het is een mengsel van SO3 monomeer (enkel molecuul) en trimeer (3 moleculen gehecht) met formule S.3OF9, ook wel SO genoemd3 gamma γ-SO3.
Als de temperatuur daalt, als de SO3 het is zuiver als het 16,86 ºC bereikt, het stolt of bevriest tot γ-SO3, ook wel "SO ijs3.
Als het kleine hoeveelheden vocht bevat (zelfs sporen of extreem kleine hoeveelheden) de SO3 polymeriseert tot de beta β-SO-vorm3 die kristallen vormt met een zijdezachte glans.
Vervolgens worden er meer bindingen gevormd die de alpha α-SO-structuur genereren3, dat is een naaldvormige kristallijne vaste stof die op asbest of asbest lijkt.
Wanneer alfa en bèta samenkomen, genereren ze gamma.
Molecuulgewicht
80,07 g / mol
Smeltpunt
SW3 gamma = 16,86 ºC
Drievoudig punt
Het is de temperatuur waarbij de drie fysische toestanden aanwezig zijn: vast, vloeibaar en gas. In de alfavorm ligt het tripelpunt op 62,2 ºC en in de bèta op 32,5 ºC.
Het verwarmen van de alfavorm heeft een grotere neiging tot sublimeren dan tot smelten. Sublimeren betekent direct van de vaste toestand naar de gasvormige toestand gaan, zonder door de vloeibare toestand te gaan.
Kookpunt
Alle vormen van OS3 kook op 44,8 ºC.
Dichtheid
De SO3 vloeistof (gamma) heeft een dichtheid van 1,9225 g / cm3 bij 20 ºC.
De SO3 gasvormig heeft een dichtheid van 2,76 ten opzichte van lucht (lucht = 1), wat aangeeft dat het zwaarder is dan lucht.
Dampdruk
SW3 alpha = 73 mm Hg bij 25 ºC
SW3 beta = 344 mm Hg bij 25 ºC
SW3 gamma = 433 mm Hg bij 25 ºC
Dit betekent dat de gammavorm de neiging heeft gemakkelijker te verdampen dan bèta en dit dan alfa..
Stabiliteit
De alfavorm is de meest stabiele structuur, de andere zijn metastabiel, dat wil zeggen, ze zijn minder stabiel.
Chemische eigenschappen
De SO3 reageert heftig met water om zwavelzuur H te geventweeSW4. Bij het reageren komt er veel warmte vrij, waardoor er snel waterdamp uit het mengsel vrijkomt.
Wordt blootgesteld aan de lucht de SO3 absorbeert snel vocht en geeft dichte dampen af.
Het is een zeer sterk dehydratatiemiddel, dit betekent dat het gemakkelijk water uit andere materialen verwijdert.
Zwavel in SO3 heeft affiniteit voor vrije elektronen (dat wil zeggen elektronen die niet in een binding tussen twee atomen zijn), dus het heeft de neiging complexen te vormen met verbindingen die ze bezitten, zoals pyridine, trimethylamine of dioxaan.
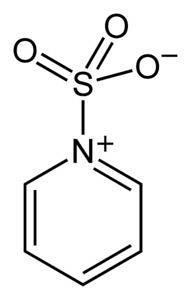
Door complexen te vormen, "leent" zwavel elektronen van de andere verbinding om het gebrek eraan op te vullen. Zwaveltrioxide is nog steeds beschikbaar in deze complexen, die in chemische reacties worden gebruikt om SO te leveren3.
Het is een krachtig sulfonantreagens voor organische verbindingen, wat betekent dat het wordt gebruikt om gemakkelijk een -SO-groep toe te voegen3- aan moleculen.
Reageert gemakkelijk met de oxiden van veel metalen om sulfaten van deze metalen te geven.
Het is corrosief voor metalen, dierlijk en plantaardig weefsel.
De SO3 Het is om verschillende redenen moeilijk te hanteren: (1) het kookpunt is relatief laag, (2) het heeft de neiging om vaste polymeren te vormen bij temperaturen onder 30 ºC en (3) het heeft een hoge reactiviteit ten opzichte van bijna alle organische stoffen. stoffen en het water.
Het kan explosief polymeriseren als het geen stabilisator bevat en er vocht aanwezig is. Dimethylsulfaat of booroxide worden als stabilisatoren gebruikt..
Het verkrijgen van
Het wordt verkregen door de reactie bij 400 ºC tussen zwaveldioxide SOtwee en moleculaire zuurstof Otwee. De reactie is echter erg traag en er zijn katalysatoren nodig om de reactiesnelheid te verhogen..
2 ZOtwee + OFtwee ⇔ 2 ZO3
Onder de verbindingen die deze reactie versnellen, zijn het platinametaal Pt, vanadiumpentoxide VtweeOF5, ijzeroxide FetweeOF3 en stikstofmonoxide NO.
Toepassingen
Bij de bereiding van oleum
Een van de belangrijkste toepassingen is de bereiding van oleum of rokend zwavelzuur, zo genoemd omdat het dampen afgeeft die zichtbaar zijn voor het blote oog. Om het te verkrijgen, wordt de SO geabsorbeerd3 in geconcentreerd zwavelzuur HtweeSW4.

Dit gebeurt in speciale roestvrijstalen torens waar het geconcentreerde zwavelzuur (dat vloeibaar is) naar beneden gaat en de SO3 frisdrank stijgt.
De vloeistof en het gas komen in contact en komen samen, waarbij oleum wordt gevormd, wat een olieachtige vloeistof is. Dit bezit een mengsel van HtweeSW4 En dus3, maar het heeft ook zwavelzuurmoleculen HtweeStweeOF7 en trisulfuric HtweeS3OF10.
Bij sulfonering chemische reacties
Sulfonering is een sleutelproces in grootschalige industriële toepassingen voor de productie van wasmiddelen, oppervlakteactieve stoffen, kleurstoffen, pesticiden en farmaceutische producten..
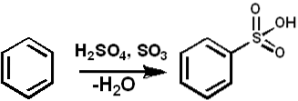
De SO3 het dient als een sulfoneringsmiddel om gesulfoneerde oliën en alkyl-aryl-gesulfoneerde wasmiddelen te bereiden, naast vele andere verbindingen. Het volgende toont de sulfoneringsreactie van een aromatische verbinding:
ArH + SO3 → ArSO3H.
Oleum of SO kan worden gebruikt voor sulfoneringsreacties.3 in de vorm van zijn complexen met onder andere pyridine of trimethylamine.
Bij de winning van metalen
ZO gas3 Het is gebruikt bij de behandeling van mineralen. Eenvoudige oxiden van metalen kunnen veel beter oplosbare sulfaten worden door ze te behandelen met SO3 bij relatief lage temperaturen.
Sulfidemineralen zoals pyriet (ijzersulfide), chalcosine (kopersulfide) en milleriet (nikkelsulfide) zijn de meest economische bronnen van non-ferrometalen, dus behandeling met SO3 maakt het mogelijk deze metalen gemakkelijk en tegen lage kosten te verkrijgen.
IJzer-, nikkel- en kopersulfiden reageren met SO-gas3 zelfs bij kamertemperatuur, waarbij de respectieve sulfaten worden gevormd, die zeer oplosbaar zijn en kunnen worden onderworpen aan andere processen om het zuivere metaal te verkrijgen.
In verschillende toepassingen
De SO3 gebruikt om chloorzwavelzuur te bereiden, ook wel chloorsulfonzuur HSO genoemd3Cl.
Zwaveltrioxide is een zeer krachtig oxidatiemiddel en wordt gebruikt bij de vervaardiging van explosieven..
Risico's
Voor de gezondheid
De SO3 Het is een zeer giftige verbinding via alle routes, dat wil zeggen bij inademing, inslikken en contact met de huid.
Irriterende en corrosieve slijmvliezen. Veroorzaakt brandwonden aan huid en ogen. De dampen zijn zeer giftig bij inademing. Interne brandwonden, kortademigheid, pijn op de borst en longoedeem treden op.

Het is giftig. De inname ervan veroorzaakt ernstige brandwonden aan mond, slokdarm en maag. Bovendien wordt ervan verdacht kankerverwekkend te zijn.
Van brand of explosie
Het vormt een brandgevaar bij contact met materialen van organische oorsprong zoals hout, vezels, papier, olie, katoen, onder andere, vooral als ze nat zijn..
Er is ook een risico als u in contact komt met basen of reductiemiddelen. Combineert explosief met water en vormt zwavelzuur.
Bij contact met metalen kan waterstofgas H ontstaantwee die zeer brandbaar is.
Verhitting in glazen potten moet worden vermeden om mogelijk gewelddadig scheuren van de container te voorkomen..
Milieu-impact
De SO3 Het wordt beschouwd als een van de belangrijkste verontreinigende stoffen in de atmosfeer van de aarde. Dit komt door zijn rol bij de vorming van aërosolen en zijn bijdrage aan zure regen (door de vorming van zwavelzuur HtweeSW4.

De SO3 wordt gevormd in de atmosfeer door de oxidatie van zwaveldioxide SOtwee. Bij het vormen van de SO3 het reageert snel met water om zwavelzuur H te vormentweeSW4. Volgens recente studies zijn er andere mechanismen voor transformatie van SO3 in de atmosfeer, maar vanwege de grote hoeveelheid water die erin aanwezig is, wordt het nog steeds veel waarschijnlijker geacht dat SO3 wordt voornamelijk HtweeSW4.
De SO3 Gas of gasvormig industrieel afval dat het bevat, mag niet in de atmosfeer worden geloosd omdat het een gevaarlijke verontreinigende stof is. Het is een zeer reactief gas en, zoals al eerder is gezegd, in aanwezigheid van vocht in de lucht SO3 wordt zwavelzuur HtweeSW4. Daarom is in de lucht de SO3 blijft bestaan in de vorm van zwavelzuur en vormt kleine druppeltjes of aerosol.
Als de zwavelzuurdruppeltjes de luchtwegen van mensen of dieren binnendringen, groeien ze snel in omvang door het daar aanwezige vocht, waardoor ze kans hebben om de longen binnen te dringen. Een van de mechanismen waardoor de zure nevel van HtweeSW4 (d.w.z. SO3) kan een sterke toxiciteit veroorzaken omdat het de extracellulaire en intracellulaire pH van levende organismen (planten, dieren en mensen) verandert.
Volgens sommige onderzoekers is mist afkomstig van SO3 Het is de oorzaak van de toename van astmapatiënten in een deel van Japan. ZO mist3 Het heeft een zeer corrosief effect op metalen, zodat door mensen gebouwde metalen constructies, zoals sommige bruggen en gebouwen, ernstig kunnen worden aangetast..
De SO3 Vloeistof mag niet worden afgevoerd via riolering of riolering. Als het in riolen wordt gemorst, kan dit brand- of explosiegevaar opleveren. Richt de waterstraal niet op het product als dit per ongeluk wordt gemorst. Het mag nooit worden geabsorbeerd in zaagsel of ander brandbaar absorptiemiddel, aangezien dit brand kan veroorzaken.
Het moet worden geabsorbeerd in droog zand, droge aarde of een ander volledig droog inert absorptiemiddel. De SO3 Het mag niet in het milieu terechtkomen en mag er nooit mee in aanraking komen. Het moet uit de buurt van waterbronnen worden gehouden, omdat het hiermee zwavelzuur produceert dat schadelijk is voor water- en landorganismen..
Referenties
- Sarkar, S. et al. (2019). Invloed van ammoniak en water op het lot van zwaveltrioxide in de troposfeer: theoretisch onderzoek naar routes voor de vorming van sulfaminezuur en zwavelzuur. J Phys Chem A. 2019; 123 (14): 3131-3141. Opgehaald van ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Zwavelzuur en zwaveltrioxide. Kirk-Othmer Encyclopedia of Chemical Technology. Deel 23. Hersteld van onlinelibrary.wiley.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Zwaveltrioxide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Milieubeheer van zwaveltrioxide-emissie: impact van SO3 over de menselijke gezondheid. Environmental Management (2001) 27: 837. Hersteld van link.springer.com.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Ismail, M.I. (1979). Extractie van metalen uit sulfiden met behulp van zwaveltrioxide in wervelbed. J. Chem Tech Biotechnol. 1979, 29, 361-366. Hersteld van onlinelibrary.wiley.com.



Niemand heeft nog op dit artikel gereageerd.