
Cerium (IV) oxide structuur, eigenschappen, gebruik

De cerium (IV) oxide u ceriumoxide is een witte of lichtgele anorganische vaste stof die wordt geproduceerd door de oxidatie van cerium (Ce) door zuurstof tot zijn 4+ valentie. De chemische formule van ceric oxide is CeOtwee en is het meest stabiele oxide van cerium.
Cerium (Ce) is een element van de reeks lanthaniden, die zijn opgenomen in de groep van zeldzame aardmetalen. De natuurlijke bron van dit oxide is het mineraal bastnasiet. In het commerciële concentraat van dit mineraal de CeOtwee kan worden gevonden in een geschatte hoeveelheid tot 30 gew.%.

De CEOtwee kan gemakkelijk worden verkregen door cerium (III) hydroxide, Ce (OH) in lucht of zuurstof te verhitten3, of elk zout van cerium (III), zoals oxalaat, carbonaat of nitraat.
De CEOtwee Stoichiometrisch kan worden verkregen door reactie van cerium (III) oxide bij hoge temperatuur met elementaire zuurstof. Er moet een overmaat aan zuurstof zijn en er moet voldoende tijd worden gelaten om de omzetting van de verschillende niet-stoichiometrische fasen die worden gevormd, te voltooien..
Deze fasen bestaan uit meerkleurige producten met de CeO-formuleX (waarbij x varieert tussen 1,5 en 2,0). Ze worden ook wel CeO genoemd2-x, waarbij x een waarde van maximaal 0,3 kan hebben. De CEOtwee Het is de meest gebruikte vorm van Ce in de industrie. Het heeft een lage toxiciteitsclassificatie, vooral vanwege de slechte oplosbaarheid in water..

Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3,2 Mohs-hardheid
- 3.3 Molecuulgewicht
- 3.4 Smeltpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3.7 Brekingsindex
- 3.8 Overige eigenschappen
- 4 toepassingen
- 4.1 - In de metallurgische industrie
- 4.2 - In de glasindustrie
- 4.3 - In email
- 4.4 - Van zirkoniumoxide keramiek
- 4.5 - In katalysatoren voor emissiebeperking van voertuigen
- 4.6 - Bij katalyse van chemische reacties
- 4.7 - In biologische en biomedische toepassingen
- 4.8 - Andere toepassingen
- 5 referenties
Structuur
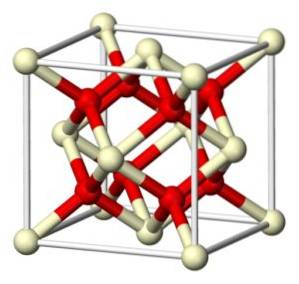
Stoichiometrisch cerium (IV) oxide kristalliseert in het fluorietachtige kubische rooster (CaFtwee), met 8 O-ionentwee- in een kubusvormige structuur gecoördineerd met 4 Ce-ionen4+.
Nomenclatuur
- Cerium (IV) oxide.
- Cerisch oxide.
- Ceriumdioxide.
- Ceria.
- Stoichiometrisch ceriumoxide: materiaal volledig gemaakt van CeOtwee.
- Niet-stoichiometrisch ceriumoxide: materiaal gevormd door gemengde oxiden van CeOtwee tot aan de CeO1.5
Eigendommen
Fysieke toestand
Lichtgele vaste stof. Kleur is gevoelig voor stoichiometrie en de aanwezigheid van andere lanthaniden. Niet-stoichiometrische oxiden zijn vaak blauw.
Mohs-hardheid
6-6.1 ongeveer.
Molecuulgewicht
172,12 g / mol.
Smeltpunt
Ongeveer 2600 ºC.
Dichtheid
7,132 g / cm3
Oplosbaarheid
Onoplosbaar in warm en koud water. Oplosbaar in geconcentreerd zwavelzuur en geconcentreerd salpeterzuur. Onoplosbaar in verdunde zuren.
Brekingsindex
2.2.
Andere eigenschappen
De CEOtwee Het is een inerte stof, het wordt niet aangetast door sterke zuren of logen. Het kan echter worden opgelost door zuren in aanwezigheid van reductiemiddelen, zoals waterstofperoxide (H.tweeOFtwee) of tin (II), onder andere genererende oplossingen van cerium (III).
Het heeft een hoge thermische stabiliteit. Ondergaat geen kristallografische veranderingen tijdens gebruikelijke verwarmingsintervallen.
Het gehydrateerde derivaat (CeOtwee.nHtweeO) is een geel en gelatineus neerslag dat wordt verkregen door oplossingen van cerium (IV) te behandelen met basen.
De CEOtwee het wordt slecht geabsorbeerd uit het maagdarmkanaal en heeft dus geen toxische effecten.
Toepassingen
- In de metallurgische industrie
De CEOtwee gebruikt op de elektroden van bepaalde lastechnieken, zoals wolfraambooglassen met inert gas.
Het oxide is fijn gedispergeerd door de wolfraammatrix. Bij lage spanningen zijn deze CeO-deeltjestwee geven een grotere betrouwbaarheid dan wolfraam alleen.
- In de glasindustrie
Glas polijsten
Ceriumoxide is het meest efficiënte polijstmiddel voor de meeste commerciële glassamenstellingen. De CEOtwee heeft bijna volledig andere polijstoxiden, zoals Fe, vervangentweeOF3, silica en ZrOtwee, vanwege de hogere polijstsnelheid en reiniging, die toenemen naarmate de zuiverheid van het oxide toeneemt.
Commerciële glaspoetsmiddelen op basis van ceriumoxidepoeders hebben gedefinieerde deeltjesgrootten en gecontroleerde dispergeerbaarheid in waterige systemen..
Het glaspolijstproces vereist water en wat wordt verwijderd of opnieuw gevormd, is een zachtere gehydrateerde oppervlaktelaag. Het polijstmiddel moet een Mohs-hardheid hebben van ongeveer 6,5, wat de hardheid van de meeste soorten glas benadert.
Ceriumoxide in water bevat het Ce (IV) / Ce (III) -paar dat met zijn oxidatiereductiereacties chemische hulp kan bieden tijdens de afbraak van het glassilicaatnetwerk.
De CEOtwee met een hoge zuiverheidsgraad wordt het gebruikt om spiegels, televisietoestellen, oftalmische lenzen en precisie-optisch materiaal te behandelen.
Verkleuring van het glas
De CEOtwee kan natronkalkglas voor flessen, kannen en dergelijke verkleuren. Ce (IV) oxideert Fe (II) onzuiverheden, die een blauwgroene kleur geven, tot Fe (III) dat een 10 keer zwakkere gele kleur geeft.
Stralingsbestendig glas
De toevoeging van 1% CeOtwee al glas onderdrukt verkleuring of donker worden van het glas veroorzaakt door het bombardement van hoogenergetische elektronen in tv-brillen. Hetzelfde geldt voor glas dat wordt gebruikt in ramen in hete cellen in de nucleaire industrie, omdat het door gammastraling veroorzaakte verkleuring onderdrukt..
Aangenomen wordt dat het onderdrukkingsmechanisme afhankelijk is van de aanwezigheid van Ce-ionen4+ en Ce3+ in het glazen net.
Lichtgevoelige bril
Sommige glasformuleringen kunnen latente beelden ontwikkelen die vervolgens kunnen worden omgezet in een permanente structuur of kleur..
Dit type glas bevat CeOtwee die UV-straling absorbeert en elektronen afgeeft in de glasmatrix.
Na de behandeling wordt de groei van kristallen van andere verbindingen in het glas gegenereerd, waardoor gedetailleerde patronen ontstaan voor elektronische of decoratieve toepassingen..
- In email
Vanwege zijn hoge brekingsindex, CeOtwee is een troebelingsmiddel in glazuursamenstellingen die worden gebruikt als beschermende coatings op metalen.
Zijn hoge thermische stabiliteit en zijn unieke kristallografische vorm over het hele temperatuurbereik dat tijdens het glazuurproces wordt bereikt, maken het geschikt voor gebruik in porseleinemail..
In deze applicatie is de CeOtwee Geeft de gewenste witte coating tijdens het doorbranden van het glazuur. Het is het ingrediënt dat voor ondoorzichtigheid zorgt.
- Van zirkoniumkeramiek
Zirkoniumkeramiek is een thermische isolator en wordt gebruikt in toepassingen op hoge temperatuur. Het vereist een additief om een hoge sterkte en taaiheid te hebben. CeO toevoegentwee Zirkoniumoxide produceert een materiaal met een uitzonderlijke taaiheid en goede weerstand.
CeO-gedoteerd zirkoniumoxidetwee gebruikt in coatings om te fungeren als thermische barrière op metalen oppervlakken.
In onderdelen van vliegtuigmotoren beschermen deze coatings bijvoorbeeld tegen de hoge temperaturen waaraan metalen zouden worden blootgesteld..
- In katalysatoren voor emissiebeheersing van voertuigen
De CEOtwee Het is een actieve component bij het verwijderen van verontreinigende stoffen uit voertuigemissies. Dit komt grotendeels door het vermogen om zuurstof op te slaan of af te geven, afhankelijk van de omstandigheden eromheen..
De katalysator in motorvoertuigen bevindt zich tussen de motor en de uitlaatgasafvoer. Het heeft een katalysator die onverbrande koolwaterstoffen moet oxideren, CO moet omzetten in COtwee, en verminder stikstofoxiden, NOX, naar Ntwee metwee.

Naast platina en andere katalytische metalen is de belangrijkste actieve component van deze multifunctionele systemen CeOtwee.
Elke katalysator bevat 50-100 g CeOtwee fijn verdeeld, die verschillende functies dient. De belangrijkste zijn:
Werkt als een stabilisator voor aluminiumoxide met een groot oppervlak
Aluminiumoxide met een groot oppervlak heeft de neiging te sinteren en verliest zijn grote oppervlak tijdens bedrijf bij hoge temperaturen. Dit wordt vertraagd door de aanwezigheid van CeOtwee.
Het gedraagt zich als een zuurstofbuffer-releaser
Vanwege zijn vermogen om niet-stoichiometrische oxiden CeO te vormen2-x, cerium (IV) oxide levert elementaire zuurstof van zijn eigen structuur tijdens de zuurstofarme / brandstofrijke cyclusperiode.
Zo kan de oxidatie van onverbrande koolwaterstoffen die uit de motor komen en de omzetting van CO in CO doorgaan.twee, zelfs als gasvormige zuurstof onvoldoende is.
Vervolgens, in de zuurstofrijke cyclusperiode, neemt het de zuurstof op en oxideert opnieuw, waarbij het zijn stoichiometrische vorm terugkrijgt CeOtwee.
Anderen
Het werkt als een versterker van de katalytische capaciteit van rhodium bij de reductie van stikstofoxiden NOX aan stikstof en zuurstof.
- Bij katalyse van chemische reacties
In de katalytische kraakprocessen van raffinaderijen, CeOtwee werkt als een katalytisch oxidatiemiddel dat helpt bij de omzetting van SOtwee tot SO3 en bevordert de vorming van sulfaten in specifieke vallen van het proces.
De CEOtwee verbetert de activiteit van de op ijzeroxide gebaseerde katalysator die wordt gebruikt om styreen te verkrijgen uitgaande van ethylbenzeen. Dit komt mogelijk door de positieve interactie tussen de oxide-reductieparen Fe (II) - Fe (III) en Ce (III) - Ce (IV).
- In biologische en biomedische toepassingen
Er zijn CeO-nanodeeltjes gevondentwee werken door het wegvangen van vrije radicalen, zoals superoxide, waterstofperoxide, hydroxyl en stikstofmonoxide radicaal.
Ze kunnen biologische weefsels beschermen tegen door straling veroorzaakte schade, lasergeïnduceerde schade aan het netvlies, de levensduur van fotoreceptorcellen verlengen, rugletsel verminderen, chronische ontstekingen verminderen en angiogenese of bloedvatvorming bevorderen.
Bovendien bevatten bepaalde nanovezels CeO-nanodeeltjestwee zijn toxisch gebleken tegen bacteriestammen, omdat ze veelbelovende kandidaten zijn voor bacteriedodende toepassingen.
- Andere gebruiken
De CEOtwee Het is een elektrisch isolerend materiaal vanwege zijn uitstekende chemische stabiliteit, hoge relatieve permittiviteit (het heeft een sterke neiging tot polariseren wanneer een elektrisch veld wordt aangelegd) en een kristallijn rooster dat lijkt op silicium..
Het is toegepast in condensatoren en dempingslagen van supergeleidende materialen.
Het wordt ook gebruikt in gassensoren, vaste-oxide brandstofcelelektrodematerialen, zuurstofpompen en zuurstofmonitors..
Referenties
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm en Trotman-Dickenson, A.F. (1973). Uitgebreide anorganische chemie. Deel 4. Pergamon Press.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Deel 5. Vierde editie. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. Deel A6. VCH Verlagsgesellschaft mbH.
- Casals, Eudald et al. (2012). Analyse en risico van nanomaterialen in milieu- en voedselmonsters. In uitgebreide analytische chemie. Opgehaald van sciencedirect.com.
- Mailadil T.Sebastian. (2008). Alumina, titania, ceriumoxide, silicaat, wolframaat en andere materialen. In diëlektrische materialen voor draadloze communicatie. Opgehaald van sciencedirect.com.
- Afeesh Rajan Unnithan, et al. (2015). Steigers met antibacteriële eigenschappen. In nanotechnologietoepassingen voor weefselengineering. Opgehaald van sciencedirect.com.
- Gottardi V., et al. (1979). Het polijsten van het oppervlak van een glas onderzocht met een nucleaire techniek. Bulletin of the Spanish Society of Ceramics and Glass, deel 18, nr. 3. Hersteld van boletines.secv.es.


Niemand heeft nog op dit artikel gereageerd.