
Goud (III) oxide (Au2O3) structuur, eigenschappen en toepassingen
De goud (III) oxide is een anorganische verbinding waarvan de chemische formule Au istweeOF3. Theoretisch kan worden verwacht dat de aard ervan van het covalente type is. De aanwezigheid van een bepaald ionisch karakter in zijn vaste stof kan echter niet volledig worden uitgesloten; of wat hetzelfde is, neem aan dat er geen Au cation is3+ naast het anion Otwee-.
Het lijkt misschien tegenstrijdig dat goud, omdat het een edel metaal is, kan roesten. Onder normale omstandigheden kunnen stukjes goud (zoals de sterren in de onderstaande afbeelding) niet worden geoxideerd door contact met zuurstof in de atmosfeer; echter bij bestraling met ultraviolette straling in aanwezigheid van ozon, OR3, het panorama is anders.

Als gouden sterren aan deze voorwaarden zouden worden onderworpen, zouden ze een roodbruine kleur krijgen, kenmerkend voor AutweeOF3.
Andere methoden om dit oxide te verkrijgen zouden de chemische behandeling van genoemde sterren inhouden; bijvoorbeeld door de massa van goud om te zetten in zijn respectievelijke chloride, AuCl3.
Vervolgens naar AuCl3, en aan de rest van de mogelijke gevormde goudzouten wordt een sterk basismedium toegevoegd; en hiermee wordt het gehydrateerde oxide of hydroxide verkregen, Au (OH)3. Ten slotte wordt deze laatste verbinding thermisch gedehydrateerd om Au te verkrijgentweeOF3.
Artikel index
- 1 Structuur van goud (III) oxide
- 1.1 Elektronische aspecten
- 1.2 Hydrateert
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molecuulmassa
- 2.3 Dichtheid
- 2.4 Smeltpunt
- 2.5 Stabiliteit
- 2.6 Oplosbaarheid
- 3 Nomenclatuur
- 4 toepassingen
- 4.1 Glaskleuring
- 4.2 Synthese van auraten en fulminant goud
- 4.3 Omgaan met zelf-geassembleerde monolagen
- 5 referenties
Structuur van goud (III) oxide
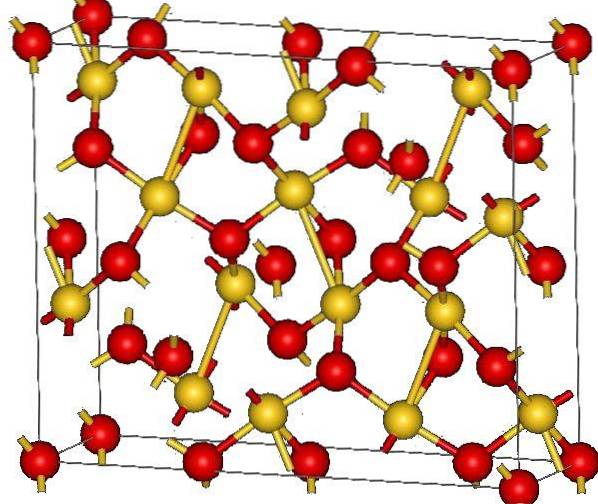
De bovenste afbeelding toont de kristalstructuur van goud (III) oxide. De rangschikking van de goud- en zuurstofatomen in de vaste stof wordt weergegeven, hetzij als neutrale atomen (covalente vaste stof) of ionen (ionische vaste stof). Onverschillig genoeg is het in ieder geval voldoende om de Au-O-links te verwijderen of te plaatsen.
Volgens de afbeelding wordt aangenomen dat het covalente karakter overheerst (wat logisch zou zijn). Om die reden worden de atomen en bindingen weergegeven met respectievelijk bollen en staven weergegeven. De gouden bollen komen overeen met de goudatomen (AuIII-O), en de roodachtige zuurstofatomen.
Als je goed kijkt, zie je dat er AuO-units zijn4, die zijn verbonden door zuurstofatomen. Een andere manier om het te visualiseren zou zijn om te overwegen dat elke Au3+ is omgeven door vier O'stwee-natuurlijk vanuit een ionisch perspectief.
Deze structuur is kristallijn omdat de atomen gerangschikt zijn volgens hetzelfde lange-afstandspatroon. De eenheidscel komt dus overeen met het rhombohedrale kristallijne systeem (dezelfde in de bovenste afbeelding). Daarom zijn alle AutweeOF3 kon worden geconstrueerd als al die bollen van de eenheidscel in de ruimte waren verdeeld.
Elektronische aspecten
Goud is een overgangsmetaal en de 5d-orbitalen zullen naar verwachting rechtstreeks interageren met de 2p-orbitalen van het zuurstofatoom. Deze overlapping van hun orbitalen zou theoretisch geleidingsbanden moeten genereren, die Au zouden converterentweeOF3 in een solide halfgeleider.
Daarom is de ware structuur van AutweeOF3 met dit in gedachten is het zelfs nog complexer.
Hydrateert
Goudoxide kan watermoleculen vasthouden in zijn rhombohedrale kristallen, waardoor hydraten ontstaan. Wanneer dergelijke hydraten worden gevormd, wordt de structuur amorf, dat wil zeggen wanordelijk.
De chemische formule voor dergelijke hydraten kan een van de volgende zijn, die in feite niet volledig zijn opgehelderd: AutweeOF3∙ zHtweeO (z = 1, 2, 3, enz.), Au (OH)3, of AuXOFY(OH)z.
De formule Au (OH)3 vertegenwoordigt een te grote vereenvoudiging van de werkelijke samenstelling van genoemde hydraten. Dit komt omdat onderzoekers in het goud (III) hydroxide ook de aanwezigheid van Au hebben gevondentweeOF3en daarom heeft het geen zin om het geïsoleerd te behandelen als een "eenvoudig" overgangsmetaalhydroxide.
Aan de andere kant, van een vaste stof met formule AuXOFY(OH)z een amorfe structuur kan worden verwacht; omdat het afhangt van de coëfficiënten X, Y Y z, waarvan de variaties aanleiding zouden geven tot allerlei soorten structuren die nauwelijks een kristallijn patroon konden vertonen.
Eigendommen
Fysiek uiterlijk
Het is een roodbruine vaste stof.
Moleculaire massa
441,93 g / mol.
Dichtheid
11,34 g / ml.
Smeltpunt
Smelt en ontleedt bij 160ºC. Daarom mist het een kookpunt, zodat dit oxide nooit kookt..
Stabiliteit
AUtweeOF3 het is thermodynamisch onstabiel omdat, zoals in het begin vermeld, goud niet de neiging heeft te oxideren onder normale temperatuuromstandigheden. Het wordt dus gemakkelijk gereduceerd om weer het edele goud te worden.
Hoe hoger de temperatuur, hoe sneller de reactie, die bekend staat als thermische ontleding. Zo is de AutweeOF3 bij 160 ° C ontleedt het om metallisch goud te produceren en moleculaire zuurstof vrij te maken:
2 AutweeOF3 => 4 Au + 3 Otwee
Een zeer vergelijkbare reactie kan optreden met andere verbindingen die deze reductie bevorderen. Waarom reductie? Omdat goud de elektronen terugwint die zuurstof eruit nam; wat hetzelfde is als zeggen dat het de banden met zuurstof verliest.
Oplosbaarheid
Het is een vaste stof die onoplosbaar is in water. Het is echter oplosbaar in zoutzuur en salpeterzuur, vanwege de vorming van goudchloriden en nitraten..
Nomenclatuur
Goud (III) oxide is de naam die wordt beheerst door de voorraadnomenclatuur. Andere manieren om het te noemen zijn:
-Traditionele nomenclatuur: aurisch oxide, omdat de 3+ valentie het hoogst is voor goud.
-Systematische nomenclatuur: diorotrioxide.
Toepassingen
Glaskleuring
Een van de meest vooraanstaande toepassingen is om een roodachtige kleur toe te voegen aan bepaalde materialen, zoals glas, naast het verlenen van bepaalde eigenschappen die inherent zijn aan goudatomen..
Synthese van auraten en fulminant goud
Als Au wordt toegevoegdtweeOF3 naar een medium waar het oplosbaar is, en in aanwezigheid van metalen, kunnen auraten neerslaan na toevoeging van een sterke base; die worden gevormd door AuO-anionen4- in het gezelschap van metalen kationen.
Ook de AutweeOF3 reageert met ammoniak om de fulminante goudverbinding, Au te vormentweeOF3(NH34. De naam is afgeleid van het feit dat het zeer explosief is.
Omgaan met zelf-geassembleerde monolagen
Bepaalde verbindingen, zoals dialkyldisulfiden, RSSR, worden niet op dezelfde manier op goud en zijn oxide geadsorbeerd. Wanneer deze adsorptie plaatsvindt, vormt zich spontaan een Au-S-binding, waarbij het zwavelatoom de chemische eigenschappen van het oppervlak vertoont en definieert, afhankelijk van de functionele groep waaraan het is gehecht..
RSSR's kunnen niet worden geadsorbeerd op AutweeOF3, maar ja op metallic goud. Daarom, als het oppervlak van het goud wordt gewijzigd en de mate van oxidatie, evenals de grootte van de deeltjes of lagen AutweeOF3, een meer heterogeen oppervlak kan worden ontworpen.
Deze oppervlakte AutweeOF3-AuSR werkt samen met de metaaloxiden van bepaalde elektronische apparaten en ontwikkelt zo toekomstige slimmere oppervlakken.
Referenties
- Wikipedia. (2018). Goud (III) oxide. Hersteld van: en.wikipedia.org
- Chemische formulering. (2018). Goud (III) oxide. Hersteld van: Formulacionquimica.com
- D. Michaud. (2016, 24 oktober). Goudoxiden. 911 Metallurg. Hersteld van: 911metallurgist.com
- Shi, R. Asahi en C. Stampfl. (2007). Eigenschappen van de goudoxiden AutweeOF3 en AutweeOf: Eerste principes onderzoek. De American Physical Society.
- Cook, Kevin M. (2013). Goudoxide als maskerende laag voor regioselectieve oppervlaktechemie. Scripties en proefschriften. Verhandeling 1460.



Niemand heeft nog op dit artikel gereageerd.