
Kaliumjodide (KI) structuur, eigenschappen, verkrijging, gebruik, risico's

De kaliumjodide is een anorganische verbinding gevormd door een kaliumion (K+) en een jodide-ion (I.-De chemische formule is KI. Het is een witte kristallijne vaste stof, ionisch van aard en zeer oplosbaar in water..
KI maakt het mogelijk verschillende chemische reacties en analyses uit te voeren en wordt gebruikt om de hoeveelheid ozon in de atmosfeer te meten. Ook gebruikt in infrarood (IR) analyseapparatuur.

Kaliumjodide wordt toegevoegd aan gewoon keukenzout om jodiumtekort bij mensen te voorkomen, aangezien dit een ernstig gezondheidsprobleem kan zijn.
Het wordt gebruikt als slijmoplossend middel omdat het helpt om slijm gemakkelijk van de ademhalingskanalen naar buiten te laten stromen. Het wordt ook gebruikt om sommige schimmelinfecties te behandelen en wordt in sommige cosmetica gebruikt.
Het wordt door dierenartsen gebruikt om dieren te genezen van problemen die vergelijkbaar zijn met die van mensen, zoals hoesten en huidinfecties. Het wordt zelfs in zeer kleine hoeveelheden aan diervoeder toegevoegd.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Chemische eigenschappen
- 3.9 Overige eigenschappen
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Bij de behandeling van hyperthyreoïdie
- 5.2 In andere medische toepassingen
- 5.3 Bij veterinaire toepassingen
- 5.4 Bij het beschermen van de schildklier bij radioactieve noodsituaties
- 5.5 Bij metingen van ozon in de atmosfeer
- 5.6 In verschillende toepassingen
- 6 Risico's
- 7 referenties
Structuur
Kaliumjodide is een ionische verbinding die wordt gevormd door het kaliumkation K+ en het jodide-anion I-, daarom is tussen de twee de binding ionisch. De oxidatietoestand van kalium is +1 en de valentie van jodium is -1.
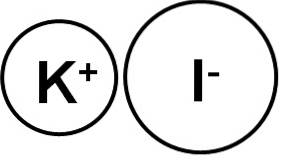
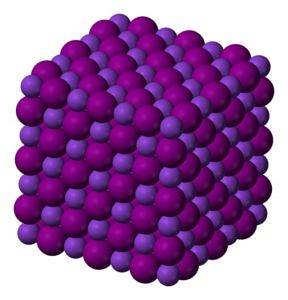
KI-kaliumjodidekristallen zijn kubisch.
Nomenclatuur
- Kaliumjodide
- Kaliumjodide
Eigendommen
Fysieke toestand
Kleurloze tot witte kristallijne vaste stof. Kubieke kristallen.
Molecuulgewicht
166,003 g / mol
Smeltpunt
681 ºC
Kookpunt
1323 ºC
Dichtheid
3,13 g / cm3
Oplosbaarheid
Zeer goed oplosbaar in water: 149 g / 100 g water bij 25 ° C. Enigszins oplosbaar in ethanol en ether.
pH
De waterige oplossingen zijn neutraal of alkalisch, met een pH tussen 7 en 9.
Chemische eigenschappen
Licht hygroscopisch in vochtige lucht.
Het is stabiel in droge lucht. Licht en vocht versnellen de afbraak en de kleur verandert in geel door het vrijkomen van kleine hoeveelheden jodium (Itwee) en jodaten (IO3-.
Waterige KI-oplossingen worden ook geel na verloop van tijd, maar een beetje alkali kan dit voorkomen.
Deze oplossingen lossen jodium op (I.twee) het geven van KI3
ik- + iktwee → ik3-
Andere eigenschappen
Het heeft een sterk bittere en zoute smaak. Het is niet brandbaar.
Het verkrijgen van
Kaliumjodide kan worden verkregen door jodium (I.twee) in een geconcentreerde oplossing van kaliumhydroxide (KOH):
3 iktwee + 6 KOH → 5 KI + KIO3 + H.tweeOF
De resulterende jodaat- en jodide-oplossing wordt verwarmd om water te verwijderen, tot droog gereduceerd, houtskool wordt toegevoegd en verwarmd tot hoge temperatuur. Steenkool neemt zuurstof uit jodaat en oxideert tot kooldioxide, waardoor jodaat wordt gereduceerd tot jodide:
2 KIO3 + C → 2 KI + 3 COtwee
Het verkregen kaliumjodide kan voor zuivering worden herkristalliseerd. Dat wil zeggen, het lost opnieuw op in water en wordt geïnduceerd om opnieuw te kristalliseren..
Toepassingen
Bij de behandeling van hyperthyreoïdie
Kaliumjodide dient als aanvullende behandeling samen met andere antithyroid-middelen om hyperthyreoïdie te behandelen.
Hyperthyreoïdie is een ziekte die ervoor zorgt dat de schildklier te veel schildklierhormoon aanmaakt, met onder meer een vergrote schildklier, een afname van het gewicht, een snelle hartslag en prikkelbaarheid..
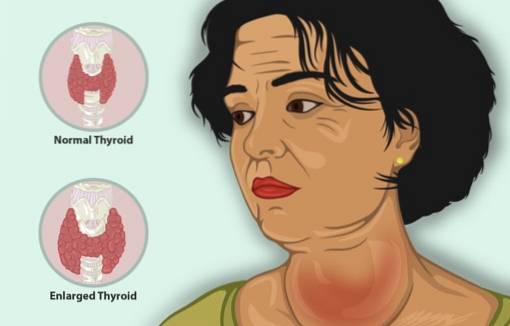
Bij patiënten met hyperthyreoïdie vermindert KI de symptomen snel omdat het de afgifte van schildklierhormoon remt.
De effecten op de schildklier zijn: afname van het aantal bloedvaten in de klier, versteviging van de weefsels en verkleining van de cellen.
Om deze reden wordt het toegepast als een preoperatieve behandeling om de involutie of afname van de grootte van de schildklier te induceren vóór een thyreoïdectomie (verwijdering van de schildklier), aangezien dit deze operatie vergemakkelijkt..
In andere medische toepassingen
Kaliumjodide heeft slijmoplossende eigenschappen omdat het de afscheiding van ademhalingsvloeistoffen verhoogt, wat resulteert in een afname van de slijmviscositeit..

Het wordt gebruikt voor de behandeling van erythema nodosum, een pijnlijke zwelling in de benen waarin zich rode knobbeltjes vormen en een temperatuurstijging..
Het is een antischimmelmiddel. Hiermee kan sporotrichose worden behandeld, een huidinfectie die wordt veroorzaakt door een schimmel. Deze ziekte komt voor bij mensen die met planten en grond werken, zoals boeren en tuinders..
Het wordt ook gebruikt bij de behandeling van jodiumtekort of om het te voorkomen en daarom wordt het toegevoegd aan keukenzout of eetbaar zout (natriumchloride NaCl) als een bron van jodium en soms in drinkwater.
In veterinaire toepassingen
Kaliumjodide wordt aan dieren toegediend als hoestwerende middelen, om het vocht in de luchtwegen te verhogen en vloeibaar te maken, bij chronische bronchiale hoest, evenals bij reuma en als ontstekingsremmer..
Het wordt ook gebruikt voor mycose (schimmelinfecties) bij dieren, om jeuk te verminderen en voor chronische vergiftiging met lood of kwik..
Bij het beschermen van de schildklier bij radioactieve noodsituaties
Kaliumjodide heeft schildklierbeschermende eigenschappen voor het geval de persoon is blootgesteld aan nucleaire straling.
KI overspoelt de schildklier met niet-radioactief jodium en blokkeert zo de opname van radioactieve moleculen en de opname van radioactief jodium, waardoor de schildklier wordt beschermd tegen kanker die straling kan veroorzaken..
Bij metingen van ozon in de atmosfeer
Ozongas (O3) kunnen in de atmosfeer worden gemeten met behulp van elektrolytische cellen, ozonesondes genaamd, die worden gedragen door radiosonde ballonnen.
Deze elektrolytische cellen bevatten een KI-kaliumjodide-oplossing. Cellen zijn aanvankelijk in chemisch en elektrisch evenwicht.
Wanneer een ozonluchtmonster (O3) een van de cellen binnendringt, wordt het evenwicht verbroken doordat de volgende reactie optreedt:
2 KI + O3 + H.tweeO → iktwee + OFtwee + 2 KOH
Deze reactie produceert een elektrische stroom die tussen de cellen stroomt..
De hoeveelheid geproduceerde elektrische stroom wordt continu door radiogolven naar een station op de grond gestuurd. Op deze manier wordt het ozonprofiel van de grond tot de hoogte van de bal verkregen..

In verschillende toepassingen
Kaliumjodide maakt ook mogelijk:
- Eliminatie van vrije radicalen zoals de hydroxylgroep OH.
- De vervaardiging van fotografische emulsies om zilver neer te slaan.
- Verbeter het diervoeder door het in microhoeveelheden toe te voegen.
- Ontgeuren van dierlijke mest.
- Zend het licht van het infraroodspectrum uit in IR-analyseapparatuur.
- Voer bepaalde chemische reacties en analyses uit in scheikundelaboratoria.
- Gebruik het in producten voor persoonlijke hygiëne.
- Voer een milieuverontreinigingsanalyse uit.
Risico's
Sommige mensen die gevoelig zijn voor jodiden, moeten het voorzichtig gebruiken, omdat het jodisme of chronische jodiumvergiftiging kan veroorzaken, bijvoorbeeld mensen met een auto-immuunziekte van de schildklier..
Mensen met tuberculose of acute bronchitis moeten ook voorzichtig zijn.
KI kan verzachting van de speekselklieren veroorzaken, het kan de mond of keel verbranden, ongebruikelijke toename van speekselvloed, tandpijn en ontsteking van het tandvlees en een metaalachtige smaak, naast andere symptomen..
Het kan ook de ogen irriteren en wonden op de huid openen..
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Kaliumjodide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Dean, J.A. (editor). (1973). Lange's Handbook of Chemistry. Elfde editie. McGraw-Hill Book Company.
- Valkovic, V. (2019). Decontaminatie na blootstelling aan straling. Meest gevoelige lichaamsdelen. In Radioactivity in the Environment (Second Edition). Opgehaald van sciencedirect.com.
- Smit, H.G.J. (2015). Chemie van de atmosfeerobservaties voor chemie (in situ). In Encyclopedia of Atmospheric Sciences (Second Edition). Opgehaald van sciencedirect.com.
- Muralikrishna, I.V. en Manickam, V. (2017). Analysemethoden voor het monitoren van milieuverontreiniging. In milieubeheer. Opgehaald van sciencedirect.com.
- Wallace, J.M. en Hobbs, P.V. (2006). Atmosferische Chemie 1. In Atmospheric Science (tweede editie). Opgehaald van sciencedirect.com.



Niemand heeft nog op dit artikel gereageerd.