
Structuur, eigenschappen, risico's en toepassingen van tertiaire butylalcohol
De tertiaire butylalcohol is een organische verbinding waarvan de formule (CH33COH of t-BuOH. Het is de eenvoudigste tertiaire alcohol van allemaal. Afhankelijk van de omgevingstemperatuur lijkt het een kleurloze vaste stof of vloeistof. De onderstaande afbeelding toont bijvoorbeeld de kleurloze kristallen.
Deze alcohol is geen substraat voor het alcoholische dehydrogenase-enzym, noch voor de peroxidase-activiteit van catalase, daarom wordt het geclassificeerd als een niet-metaboliseerbare alcohol. Vanwege zijn biochemische eigenschappen wordt aangenomen dat het nuttig zou kunnen zijn bij de detectie van hydroxylradicalen in vivo in intacte cellen..

Het is een van de vier isomeren van isobutylalcohol, waarbij het isomeer het minst vatbaar is voor oxidatie en het minst reactief. In de natuur wordt het aangetroffen in kikkererwten en cassave of maniok, een wortel die wordt gefermenteerd om alcoholische dranken te produceren..
Tertiaire butylalcohol is zeer oplosbaar in water en organische oplosmiddelen. Het wordt voornamelijk gebruikt als oplosmiddel en vervult die rol bij de productie van kunststoffen, parfums, verfverwijderaars, enz..
Zoals veel organische verbindingen is het een beetje giftig, maar in hoge doses heeft het een verdovend effect, gekenmerkt door hoofdpijn, duizeligheid, duizeligheid, duizeligheid en duizeligheid..
Artikel index
- 1 Structuur van tert-butylalcohol
- 2 Eigenschappen
- 2.1 Chemische namen
- 2.2 Moleculaire formule
- 2.3 Molecuulgewicht
- 2.4 Fysieke beschrijving
- 2.5 Geur
- 2.6 Kookpunt
- 2.7 Smeltpunt
- 2.8 Vlampunt
- 2.9 Oplosbaarheid in water
- 2.10 Oplosbaarheid in organische oplosmiddelen
- 2.11 Dichtheid
- 2.12 Dampdichtheid
- 2.13 Dampspanning
- 2.14 Verdelingscoëfficiënt octanol / water
- 2.15 Thermostabiliteit
- 2.16 Zelfontbrandingstemperatuur
- 2.17 Ontleding
- 2.18 Verdampingswarmte
- 2.19 Calorische capaciteit
- 2.20 Enthalpie van formatie
- 2.21 Opslagtemperatuur
- 2.22 Stabiliteit
- 2.23 Ionisatiepotentieel
- 2.24 Geurdrempelwaarde
- 2.25 Brekingsindex
- 2.26 Dissociatieconstante
- 2.27 Maximale dampconcentratie
- 2.28 Reacties
- 3 Risico's
- 4 toepassingen
- 5 referenties
Structuur van tert-butylalcohol
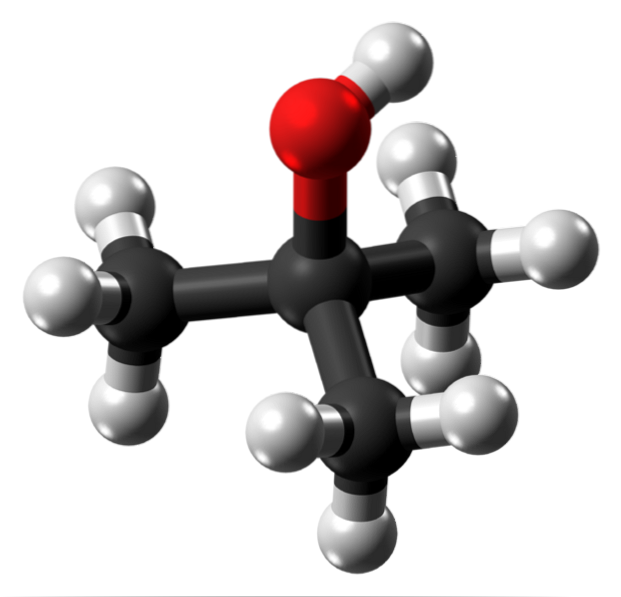
De bovenste afbeelding toont de moleculaire structuur van tert-butylalcohol met een model van bollen en staven. Het hele molecuul heeft een globale tetraëdrische geometrie, met de derde koolstof in het midden en de CH-groepen3 en OH op zijn hoekpunten.
Bij het observeren van deze structuur is het duidelijk waarom deze alcohol tertiair is: de koolstof in het centrum is gekoppeld aan drie andere koolstofatomen. Verdergaand met de tetraëder, kan het onderste deel ervan als apolair worden beschouwd, terwijl het bovenste hoekpunt polair.
Op dit hoekpunt bevindt zich de OH-groep, die een permanent dipoolmoment creëert en ook de t-BuOH-moleculen laat interageren via waterstofbruggen; op dezelfde manier als bij watermoleculen en andere polaire stoffen.
In t-BuOH-kristallen zijn deze waterstofbruggen een sleutelfactor voor de moleculen om bij elkaar te blijven; hoewel er niet veel informatie is over wat de kristallijne structuur van deze alcohol is.
Omdat de OH-groep zo dichtbij is en omringd door de apolaire groepen CH3, de watermoleculen slagen erin om bijna alle alcohol te hydrateren op hetzelfde moment dat ze een interactie aangaan met de OH. Dit zou zijn grote oplosbaarheid in water verklaren..
Eigendommen
Chemische namen
-Tertiaire butylalcohol
-tert-butanol
-2-methyl-2-propanol
-2-methylpropaan-2-ol.
Moleculaire formule
C4H.10O of (CH33COH.
Molecuulgewicht
74,123 g / mol.
Fysieke beschrijving
Kleurloze vaste stof of kleurloze vloeistof, afhankelijk van de omgevingstemperatuur, aangezien het smeltpunt 77,9 ºF (25,4 ºC) is. Boven 77,9ºF is het een vloeistof.
Geur
Net als bij kamfer.
Kookpunt
82,4 ºC.
Smeltpunt
77,9 ºF (25,4 ºC).
ontstekingspunt
52 ° F (11 ° C). Gesloten beker.
Oplosbaarheid in water
Zeer goed oplosbaar. In feite is deze alcohol, ongeacht de verhoudingen, altijd mengbaar met water..
Oplosbaarheid in organische oplosmiddelen
Mengbaar met ethanol, ethylether en oplosbaar in chloroform.
Dichtheid
0,78 g / cm3.
Dampdichtheid
2,55 (ten opzichte van lucht = 1).
Dampdruk
4,1 kPa bij 20 ºC.
Verdelingscoëfficiënt octanol / water
Log P = 0,35.
Thermostabiliteit
Instabiel in de hitte
Zelfontbranding temperatuur
896 ºF (470 ºC).
Ontleding
Bij verhitting kunnen koolmonoxide en isobutyleendampen vrijkomen.
Warmte van verdamping
39,07 kJ / mol.
Calorische capaciteit
215,37 JK-1mol-1.
Vorming-enthalpie
-360,04 tot -358,36 kJmol-1.
Bewaar temperatuur
2-8 ºC.
Stabiliteit
Het is stabiel, maar onverenigbaar met sterke oxidatiemiddelen, koper, koperlegeringen, alkalimetalen en aluminium.
Ionisatiepotentieel
9,70 eV.
Geurdrempel
219 mg / m3 (weinig geur).
Brekingsindex
1.382 bij 25 ºC.
Dissociatieconstante
pKa = 19,20.
Maximale dampconcentratie
5,53% bij 25 ºC.
Reacties
-Het wordt gedeprotoneerd door een sterke base om aanleiding te geven tot een alkoxide-anion; specifiek een terbutoxide, (CH33CO-.
-Tertiair butylalcohol reageert met waterstofchloride om tertiair butylchloride te vormen..
(CH33COH + HCl => (CH33CCl + HtweeOF
Tertiaire alcoholen hebben een grotere reactiviteit met waterstofhalogeniden dan secundaire en primaire alcoholen.
Risico's
Tert-butylalcohol veroorzaakt in contact met de huid kleine laesies, zoals niet-ernstig erytheem en hyperemie. Het gaat ook niet door de huid. Integendeel, in de ogen veroorzaakt het ernstige irritatie.
Bij inademing irriteert het de neus, keel en luchtwegen. In het geval van hoge blootstelling kunnen narcotische effecten, een slaperigheid en duizeligheid, duizeligheid en hoofdpijn optreden.
Deze alcohol is een experimenteel teratogeen middel, daarom is bij dieren waargenomen dat het het optreden van aangeboren aandoeningen kan beïnvloeden.
Wat betreft de opslag: de vloeistof en de dampen zijn ontvlambaar en kunnen daarom in bepaalde omstandigheden brand en explosies veroorzaken..
OSHA stelde een concentratielimiet vast van 100 ppm (300 mg / m3) voor een dienst van 8 uur.
Toepassingen
-Tert-butylalcohol wordt gebruikt voor de opname van de tert-butylgroep in organische verbindingen, om in olie oplosbare harsen te bereiden, en trinitro-tert-butyltolueen, een kunstmatige muskus. Bovendien vormt het een uitgangsmateriaal voor de bereiding van peroxiden.
-Het is door de FDA goedgekeurd als ontschuimingsmiddel voor gebruik op plastic materialen en componenten die in contact komen met voedsel. Het is gebruikt bij de productie van fruitessenties, kunststoffen en lakken.
-Het is een tussenproduct voor de productie van tert-butylchloride en tributylfenol. Werkt als een denaturerend middel voor ethanol.
-Het wordt gebruikt voor de vervaardiging van flotatiemiddelen, als organisch oplosmiddel om verf te verwijderen en om essences op te lossen die in parfums worden gebruikt..
-Het wordt gebruikt als octaanversterker in benzine; brandstof en brandstofadditief; oplosmiddel te gebruiken bij het reinigen en als ontvetter.
-Tert-butylalcohol is een tussenproduct bij de productie van tert-butylmethylether (MTBE) en tributylethylether (ETBE), die respectievelijk reageren met methanol en ethanol.
-Het werkt ook op dezelfde manier bij de productie van tributylhydroperoxide (TBHP) door reactie met waterstofperoxide..
-Het wordt gebruikt als een reagens in het proces dat bekend staat als Curtius-omlegging..
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Wikipedia. (2019). Tert-butylalcohol. Hersteld van: en.wikipedia.org
- CommonOrganicChemistry. (s.f.). t-Butanol. Hersteld van: commonorganicchemistry.com
- Nationaal centrum voor informatie over biotechnologie. (2019). Tert-butanol. PubChem-database. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Carey F. A. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.



Niemand heeft nog op dit artikel gereageerd.