
Anetholstructuur, eigenschappen, gebruik, toxiciteit
De anethol is een organische verbinding met molecuulformule C10H.22Of afgeleid van fenylpropeen. Het heeft een karakteristieke geur van anijsolie en een zoete smaak. Komt van nature voor in sommige etherische oliën.
Etherische oliën zijn vloeibaar bij kamertemperatuur en zijn verantwoordelijk voor de geur van planten. Ze komen voornamelijk voor in planten van de labiaceae-familie (munt, lavendel, tijm en rozemarijn) en de schermbloemige (anijs en venkel); uit de laatste wordt anethol geëxtraheerd door meesleuren met stoom.

Anijs en venkel zijn planten die anethol bevatten, een fenolische ether, die in het geval van anijs in de vrucht zit. Deze verbinding wordt gebruikt als diureticum, windafdrijvend en slijmoplossend middel. Het wordt ook aan voedsel toegevoegd om ze smaak te geven.
Het wordt gesynthetiseerd door verestering van p-cresol met methylalcohol en daaropvolgende condensatie met aldehyde. Anethol kan worden gewonnen uit planten die het bevatten door stoomdestillatie..
Anethol heeft toxische effecten en kan, afhankelijk van de plaats van contact, irritatie van de huid, ogen, luchtwegen of spijsverteringskanaal veroorzaken..
Artikel index
- 1 Structuur van anethol
- 1.1 Geometrische isomeren
- 2 Eigenschappen
- 2.1 Namen
- 2.2 Moleculaire formule
- 2.3 Fysieke beschrijving
- 2.4 Kookpunt
- 2.5 Smeltpunt
- 2.6 Vlampunt
- 2.7 Oplosbaarheid in water
- 2.8 Oplosbaarheid in organische oplosmiddelen
- 2.9 Dichtheid
- 2.10 Dampspanning
- 2.11 Viscositeit
- 2.12 Brekingsindex
- 2.13 Stabiliteit
- 2.14 Opslagtemperatuur
- 2,15 pH
- 3 toepassingen
- 3.1 Farmacologisch en therapeutisch
- 3.2 Steranijs
- 3.3 Insecticide, antimicrobiële en antiparasitaire werking
- 3.4 In eten en drinken
- 4 Toxiciteit
- 5 referenties
Structuur van anethol
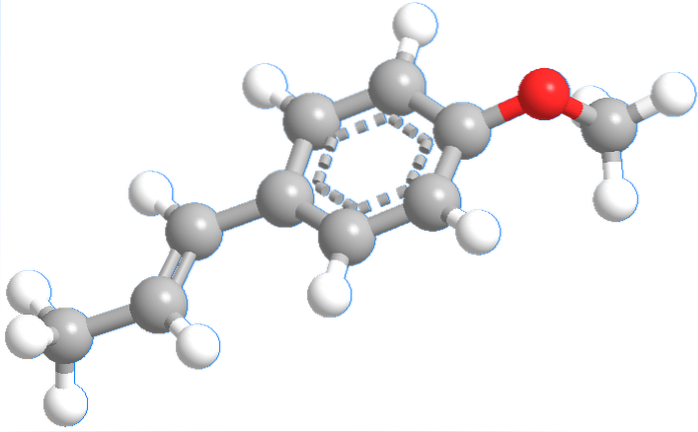
De structuur van een anetholmolecuul wordt in de bovenste afbeelding weergegeven in een bolletjes- en staafjesmodel..
Hier kun je zien waarom het een fenolische ether is: aan de rechterkant is de methoxygroep, -OCH3, en als de CH even wordt genegeerd3, je hebt de fenolische ring (met een propeensubstituent) zonder waterstof, ArO-. Daarom zou de structuurformule in samengevatte vorm kunnen worden gevisualiseerd als ArOCH3.
Het is een molecuul waarvan het koolstofskelet zich in hetzelfde vlak kan bevinden, doordat bijna al zijn atomen hybridisatie sptwee.
De intermoleculaire kracht is van het dipool-dipooltype, met de hoogste elektronendichtheid in de richting van het ringgebied en de methoxygroep. Let ook op het relatief amfifiele karakter van anethol: -OCH3 het is polair en de rest van zijn structuur is apolair en hydrofoob.
Dit feit verklaart de lage oplosbaarheid in water en gedraagt zich als elk vet of olie. Het verklaart ook zijn affiniteit voor andere vetten die in natuurlijke bronnen aanwezig zijn..
Geometrische isomeren

Anethol kan in twee isomere vormen voorkomen. De eerste afbeelding van de structuur toonde de trans (E) -vorm, de meest stabiele en overvloedige. Nogmaals, deze structuur wordt getoond in de bovenste afbeelding, maar vergezeld van zijn cis (Z) -isomeer bovenaan.
Let op het verschil tussen de twee isomeren: de relatieve positie van -OCH3 met betrekking tot de aromatische ring. In het cis-isomeer van anethol, -OCH3 is dichter bij de ring, wat resulteert in sterische hinder die het molecuul destabiliseert.
In feite is de destabilisatie zo dat eigenschappen zoals het smeltpunt worden gewijzigd. Over het algemeen hebben cis-vetten lagere smeltpunten en zijn hun intermoleculaire interacties minder efficiënt in vergelijking met transvetten..
Eigendommen
Namen
annexol en 1-methoxy-4-propenylbenzeen
Moleculaire formule
C10H.22OF
Fysieke beschrijving
Witte kristallen of kleurloze vloeistof, soms bleekgeel.
Kookpunt
454,1 ºF tot 760 mmHg (234 ºC).
Smeltpunt
704 ºF (21,3 ºC).
Ontstekingspunt
195 ºF.
Oplosbaarheid in water
Het is praktisch onoplosbaar in water (1,0 g / l) bij 25 ºC.
Oplosbaarheid in organische oplosmiddelen
In een verhouding van 1: 8 in 80% ethanol; 1: 1 in 90% ethanol.
Mengbaar met chloroform en ether. Het bereikt een concentratie van 10 mM in dimethylsulfoxide. Oplosbaar in benzeen, ethylacetaat, koolstofdisulfide en petroleumether.
Dichtheid
0,9882 g / ml bij 20 ° C.
Dampdruk
5,45 Pa bij 294 ºK.
Viscositeit
2,45 x 10-3 Evenwicht.
Brekingsindex
1.561
Stabiliteit
Stabiel, maar het is een brandbare verbinding. Onverenigbaar met sterke oxidatiemiddelen.
Bewaar temperatuur
Tussen 2 en 8 ºC.
pH
7,0.
Toepassingen
Farmacologisch en therapeutisch
Aan anetholtrithion (ATT) worden talrijke functies toegeschreven, waaronder verhoogde speekselafscheiding, wat helpt bij de behandeling van xerostomie.
In anethol en in de planten die het bevatten, is een activiteit aangetoond die verband houdt met het ademhalingssysteem en het spijsverteringsstelsel, naast een ontstekingsremmende, anticholinesterase en chemopreventieve werking..
Er is een verband tussen het anetholgehalte van een plant en zijn therapeutische werking. Daarom wordt de therapeutische werking toegeschreven aan atenol.
De therapeutische activiteiten van planten die anethol bevatten, maken ze allemaal krampstillend, windafdrijvend, antiseptisch en slijmoplossend. Ze hebben ook eupeptische, secretolytische, galactogogische eigenschappen en, bij zeer hoge doses, emenogogische activiteit..
Anethol heeft een structurele gelijkenis met dopamine, en daarom wordt erop gewezen dat het kan interageren met neurotransmitterreceptoren en de afscheiding van het hormoon prolactine induceert; verantwoordelijk voor de galactogogische werking die wordt toegeschreven aan atenol.
Steranijs
Steranijs, een culinaire smaakstof, wordt gebruikt om buikpijn te behandelen. Bovendien worden pijnstillende, neurotrope en koortsverlagende eigenschappen toegeschreven. Het wordt gebruikt als windafdrijvend middel en ter verlichting van koliek bij kinderen.
Insecticide, antimicrobiële en antiparasitaire werking
Anijs wordt gebruikt tegen bladluisinsecten (bladluizen), die de bladeren en scheuten opzuigen waardoor ze gaan krullen.
Anethol werkt als een insecticide op de larven van muggensoorten Ochlerotatus caspices Y Aedes egypti. Het werkt ook als een bestrijdingsmiddel op de mijt (spinachtige). Het heeft een insecticide werking op de kakkerlakken Blastella germanica.
Evenzo werkt het op verschillende volwassen soorten snuitkevers. Ten slotte is anethol een insectenwerend middel, vooral muggen..
Anethol werkt in op de bacteriën Enterische salmonella, bacteriedodend en bacteriostatisch werken. Vertoont antischimmelactiviteit, vooral bij soorten Saccharomyces cerevisiae Y Candida albicans, de laatste is een opportunistische soort.
Anethol oefent in vitro een anthelmintische werking uit op de eieren en larven van de nematodensoort Haemonchus contortus, gelegen in het spijsverteringskanaal van schapen.
In eten en drinken
Anethol wordt, evenals planten met een hoog gehalte aan de verbinding, als smaakstof gebruikt in veel voedingsmiddelen, dranken en banketbakkerijen, vanwege de aangename zoete smaak. Het wordt gebruikt in alcoholische dranken zoals ouzo, raki en Pernoud.
Vanwege de lage oplosbaarheid in water is anethol verantwoordelijk voor het ouzo-effect. Wanneer water aan de ouzo-likeur wordt toegevoegd, worden kleine druppels anethol gevormd die de drank vertroebelen. Dit is een bewijs van zijn authenticiteit.
Toxiciteit
Het kan door contactirritatie van de ogen en de huid veroorzaken, in de huid tot uiting komen in erytheem en oedeem die afschilfering veroorzaken. Door inslikken kan het stomatitis veroorzaken, een teken dat gepaard gaat met de toxiciteit van anethol. Bij inademing is er irritatie van de luchtwegen.
Steranijs (rijk aan anethol) kan allergieën veroorzaken, vooral bij baby's. Evenzo kan overmatige consumptie van anethol het optreden van symptomen veroorzaken, zoals spierspasmen, mentale verwarring en slaperigheid vanwege de verdovende werking..
Steranijsvergiftiging neemt toe bij intensief gebruik in de vorm van pure etherische oliën.
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Drugbank. (2017). Anethol trithion. Hersteld van: drugbank.ca
- Wees vriendelijke botanicals. (2017). Venkel en andere essentiële oliën met (E) -anethol. Hersteld van: bkbotanicals.com
- Chemisch boek. (2017). trans-Anethole. Hersteld van: chemicalbook.com
- PubChem. (2019). Anethole. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anethole. Hersteld van: en.wikipedia.org
- María E. Carretero. (s.f.). Geneeskrachtige planten met etherische olie die rijk is aan anethol. [Pdf]. Hersteld van: botplusweb.portalfarma.com
- Beheerder. (2018, 21 oktober). Wat is anethol? Vertrouwde gezondheidsproducten. Hersteld van: Trustedhealthproducts.com


Niemand heeft nog op dit artikel gereageerd.