
Capillariteitskenmerken en voorbeeld in water
De capillariteit Het is een eigenschap van vloeistoffen waardoor ze zelfs tegen de zwaartekracht in door buisvormige gaten of poreuze oppervlakken kunnen bewegen. Hiervoor moet er een evenwicht en coördinatie zijn van twee krachten die verband houden met de moleculen van de vloeistof: cohesie en adhesie; deze twee hebben een fysieke reflectie die oppervlaktespanning wordt genoemd.
De vloeistof moet de binnenwanden van de buis of de poriën van het materiaal waar het doorheen gaat, kunnen bevochtigen. Dit treedt op wanneer de adhesiekracht (vloeistof-capillaire buiswand) groter is dan de intermoleculaire cohesiekracht. Bijgevolg creëren de moleculen van de vloeistof sterkere interacties met de atomen van het materiaal (glas, papier, enz.) Dan met elkaar..
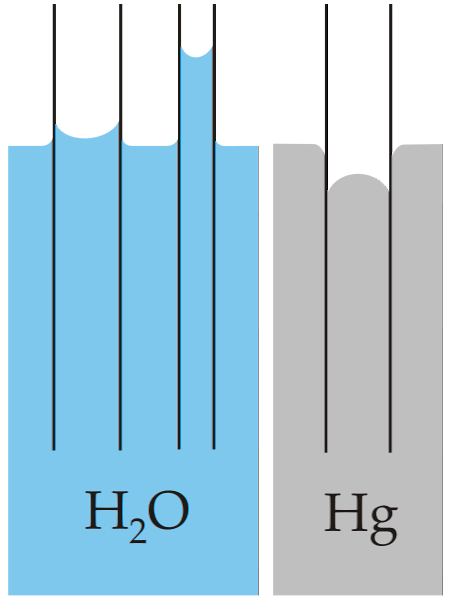
Het klassieke voorbeeld van capillariteit wordt geïllustreerd door deze eigenschap te vergelijken voor twee zeer verschillende vloeistoffen: water en kwik..
In de afbeelding hierboven is te zien dat het water de wanden van de buis oploopt, wat betekent dat het grotere adhesiekrachten heeft; terwijl bij kwik het tegenovergestelde gebeurt, omdat de cohesiekrachten van de metallische binding voorkomen dat het glas nat wordt.
Om deze reden vormt water een concave meniscus en kwik een convexe (koepelvormige) meniscus. Er moet ook worden opgemerkt dat hoe kleiner de straal van de buis of het gedeelte waar de vloeistof doorheen gaat, hoe groter de afgelegde hoogte of afstand is (vergelijk de hoogtes van de waterkolommen voor beide buizen).
Artikel index
- 1 Kenmerken van capillariteit
- 1.1 -Oppervlak van de vloeistof
- 1.2 - Hoogte
- 1.3 - Oppervlaktespanning
- 1.4 -Radius van de capillair of porie waardoor de vloeistof stijgt
- 1.5 -Contacthoek (θ)
- 2 Capillariteit van water
- 2.1 In planten
- 3 referenties
Capillariteitskenmerken
-Vloeibaar oppervlak
Het oppervlak van de vloeistof, om te zeggen water, in een capillair is concaaf; dat wil zeggen, de meniscus is concaaf. Deze situatie doet zich voor doordat de resultante van de krachten die nabij de wand van de buis op de watermoleculen worden uitgeoefend, hierop gericht is.
In elke meniscus is er een contacthoek (θ), de hoek die wordt gevormd door de wand van de capillaire buis met een lijn die raakt aan het oppervlak van de vloeistof op het contactpunt.
Hechtings- en cohesiekrachten
Als de adhesiekracht van de vloeistof aan de capillaire wand prevaleert boven de intermoleculaire cohesiekracht, dan is de hoek θ < 90º; el líquido moja la pared capilar y el agua asciende por el capilar, observándose el fenómeno conocido como capilaridad.
Wanneer een druppel water op het oppervlak van een schoon glas wordt geplaatst, verspreidt het water zich over het glas, dus θ = 0 en cos θ = 1.
Als de intermoleculaire cohesiekracht prevaleert boven de vloeistof-capillaire wandadhesiekracht, bijvoorbeeld bij kwik, zal de meniscus convex zijn en zal de hoek θ een waarde> 90º hebben; kwik maakt de capillaire wand niet nat en loopt daarom langs de binnenwand naar beneden.
Wanneer een druppel kwik op het oppervlak van een schoon glas wordt geplaatst, behoudt de druppel zijn vorm en de hoek θ = 140º.
-Hoogte
Het water stijgt door de capillaire buis totdat het een hoogte (h) bereikt, waarin het gewicht van de waterkolom de verticale component van de intermoleculaire cohesiekracht compenseert.
Naarmate er meer water stijgt, zal er een punt komen waarop de zwaartekracht stopt met opstijgen, zelfs als de oppervlaktespanning in uw voordeel werkt..
Wanneer dit gebeurt, kunnen de moleculen niet doorgaan met het "beklimmen" van de binnenmuren en worden alle fysieke krachten gelijk. Enerzijds zijn er de krachten die het stijgen van het water bevorderen, en anderzijds zijn er eigen gewicht dat het naar beneden duwt.
Jurin's wet
Dit kan wiskundig als volgt worden geschreven:
2 π rϒcosθ = ρgπrtweeh
Waar de linkerkant van de vergelijking afhangt van de oppervlaktespanning, waarvan de grootte ook gerelateerd is aan de cohesie of intermoleculaire krachten; Cosθ staat voor de contacthoek en r de straal van het gat waardoor de vloeistof opstijgt.
En aan de rechterkant van de vergelijking hebben we de hoogte h, de zwaartekracht g en de dichtheid van de vloeistof; wat zou het water zijn.
Oplossen dan voor h hebben we
h = (2ϒcosθ / ρgr)
Deze formulering staat bekend als de wet van Jurin, die de hoogte definieert die de vloeistofkolom in de capillaire buis bereikt wanneer het gewicht van de vloeistofkolom in evenwicht wordt gebracht met de kracht van de stijging door capillaire werking..
-Oppervlaktespanning
Water is een dipoolmolecuul, vanwege de elektronegativiteit van het zuurstofatoom en zijn moleculaire geometrie. Hierdoor wordt het deel van het watermolecuul waar de zuurstof zich bevindt negatief geladen, terwijl het deel van het watermolecuul, dat de 2 waterstofatomen bevat, positief geladen is..
De moleculen in de vloeistof communiceren hierdoor via meerdere waterstofbruggen, die ze bij elkaar houden. De watermoleculen die zich in het water: luchtgrensvlak (oppervlak) bevinden, worden echter onderworpen aan een netto-aantrekkingskracht door de moleculen van de sinus van de vloeistof, niet gecompenseerd door de zwakke aantrekkingskracht met de luchtmoleculen..
Daarom worden de watermoleculen aan het grensvlak onderworpen aan een aantrekkingskracht die de neiging heeft om watermoleculen van het grensvlak te verwijderen; dat wil zeggen, de waterstofbruggen gevormd met de moleculen aan de onderkant slepen die aan het oppervlak. Oppervlaktespanning probeert dus het oppervlak van het water: lucht-grensvlak te verkleinen..
Verwantschap met h
Als we kijken naar de wetvergelijking van Jurin, zullen we ontdekken dat h recht evenredig is met ϒ; daarom, hoe hoger de oppervlaktespanning van de vloeistof, hoe groter de hoogte die kan stijgen door een capillair of porie van een materiaal.
Op deze manier kan worden verwacht dat voor twee vloeistoffen, A en B, met verschillende oppervlaktespanningen, degene met de grotere oppervlaktespanning naar een hogere hoogte zal stijgen..
Met betrekking tot dit punt kan worden geconcludeerd dat een hoge oppervlaktespanning het belangrijkste kenmerk is dat de capillaire eigenschap van een vloeistof bepaalt..
-Straal van de capillair of porie waardoor de vloeistof stijgt
De waarneming van de wet van Jurin geeft aan dat de hoogte die een vloeistof bereikt in een capillair of porie omgekeerd evenredig is met de straal van dezelfde.
Daarom, hoe kleiner de straal, hoe groter de hoogte die de vloeistofkolom bereikt door capillaire werking. Dit is direct te zien in de afbeelding waar water wordt vergeleken met kwik.
In een glazen buis met een straal van 0,05 mm radius zal de waterkolom per capillariteit een hoogte bereiken van 30 cm. In capillaire buizen met een straal van 1 µm met een zuigdruk van 1,5 x 103 hPa (wat gelijk is aan 1,5 atm) komt overeen met een berekening van de hoogte van de waterkolom van 14 tot 15 m.
Dit lijkt erg op wat er gebeurt met die rietjes die zichzelf meerdere keren aanzetten. Door aan de vloeistof te nippen ontstaat er een drukverschil waardoor de vloeistof naar de mond stijgt.
De maximale hoogte van de kolom die door capillariteit wordt bereikt, is theoretisch, aangezien de straal van de capillairen niet verder dan een bepaalde limiet kan worden verkleind..
Wet van Poiseuille
Dit stelt vast dat de stroom van een echte vloeistof wordt gegeven door de volgende uitdrukking:
Q = (πr4/ 8ηl) ΔP
Waar Q de stroom van de vloeistof is, η de viscositeit is, l de lengte van de buis en ΔP het drukverschil is.
Naarmate de straal van een capillair afneemt, zou de hoogte van de vloeistofkolom die wordt bereikt door capillaire werking oneindig moeten toenemen. Poiseuille wijst er echter op dat naarmate de straal kleiner wordt, de vloeistofstroom door dit capillair ook afneemt..
Ook zou viscositeit, die een maat is voor de weerstand tegen de stroming van een echte vloeistof, de stroming van de vloeistof verder verminderen..
-Contacthoek (θ)
Hoe groter de waarde van cosθ, hoe groter de capillaire hoogte van de waterkolom, zoals aangegeven door de wet van Jurin.
Als θ klein is en nul (0) nadert, is de cosθ = 1, dus de waarde h is maximaal. Als θ daarentegen gelijk is aan 90º, is de cos the = 0 en de waarde van h = 0.
Wanneer de waarde van θ groter is dan 90º, wat het geval is bij de convexe meniscus, stijgt de vloeistof niet door capillariteit en heeft deze de neiging om te dalen (zoals bij kwik).
Capillariteit van water
Water heeft een oppervlaktespanningswaarde van 72,75 N / m, relatief hoog vergeleken met de waarden voor oppervlaktespanning van de volgende vloeistoffen:
-Aceton: 22,75 N / m
-Ethylalcohol: 22,75 N / m
-Hexaan: 18,43 N / m
-Methanol: 22,61 N / m.
Daarom heeft water een uitzonderlijke oppervlaktespanning, wat de ontwikkeling van het capillariteitsverschijnsel bevordert dat zo noodzakelijk is voor de opname van water en voedingsstoffen door planten..
In de planten

Capillariteit is een belangrijk mechanisme voor het opstijgen van het sap door het xyleem van de planten, maar het is op zichzelf onvoldoende om het sap naar de bladeren van de bomen te krijgen..
Transpiratie of verdamping is een belangrijk mechanisme bij het opstijgen van sap door het xyleem van planten. De bladeren verliezen water door verdamping, waardoor de hoeveelheid watermoleculen afneemt, waardoor de aanwezige watermoleculen in de haarvaten (xyleem) worden aangetrokken.
Watermoleculen werken niet onafhankelijk van elkaar, maar werken samen door Van der Waals-krachten, waardoor ze met elkaar verbonden via de haarvaten van planten naar de bladeren stijgen..
Naast deze mechanismen moet worden opgemerkt dat planten water uit de bodem opnemen door osmose en dat een positieve druk die in de wortel wordt gegenereerd, het begin van de stijging van water door de capillaire buizen van de plant drijft..
Referenties
- García Franco A. (2010). Oppervlakkige verschijnselen. Hersteld van: sc.ehu.es
- Oppervlakteverschijnselen: oppervlaktespanning en capillariteit. [Pdf]. Hersteld van: ugr.es
- Wikipedia. (2018). Capillariteit. Hersteld van: es.wikipedia.org
- Risvhan T. (s.f.) Capillariteit in planten. Hersteld van: academia.edu
- Helmenstine, Anne Marie, Ph.D. (22 december 2018). Capillaire werking: definitie en voorbeelden. Hersteld van: thoughtco.com
- Ellen Ellis M. (2018). Capillaire werking van water: definitie en voorbeelden. Studie. Hersteld van: study.com
- ScienceStruck-personeel. (16 juli 2017). Voorbeelden die het concept en de betekenis van capillaire werking verklaren. Hersteld van: sciencestruck.com



Niemand heeft nog op dit artikel gereageerd.