
Siliciumcarbide Chemische structuur, eigenschappen en toepassingen

De Siliciumcarbide Het is een covalente vaste stof die bestaat uit koolstof en silicium. Het heeft een grote hardheid met een waarde van 9,0 tot 10 op de schaal van Mohs, en de chemische formule is SiC, wat erop kan wijzen dat koolstof aan silicium is gebonden door een covalente drievoudige binding, met een positieve lading (+) op Si en een negatieve lading (-) op koolstof (+Ja≡C-.
Eigenlijk zijn de bindingen in deze verbinding totaal verschillend. Het werd in 1824 ontdekt door de Zweedse chemicus Jön Jacob Berzelius, terwijl hij probeerde diamanten te synthetiseren. In 1893 ontdekte de Franse wetenschapper Henry Moissani een mineraal waarvan de samenstelling siliciumcarbide bevatte.

Deze ontdekking werd gedaan tijdens het onderzoeken van rotsmonsters uit de krater van een meteoriet in Devil's Canyon, VS. Hij noemde dit mineraal moissaniet. Aan de andere kant creëerde Edward Goodrich Acheson (1894) een methode om siliciumcarbide te synthetiseren door zand of zeer zuiver kwarts te laten reageren met petroleumcokes..
Goodrich noemde het verkregen product carborundum (of carborundium) en richtte een bedrijf op om schuurmiddelen te produceren.
Artikel index
- 1 Chemische structuur
- 2 Eigenschappen
- 2.1 Algemene eigenschappen
- 2.2 Thermische eigenschappen
- 2.3 Mechanische eigenschappen
- 2.4 Elektrische eigenschappen
- 3 toepassingen
- 3.1 Als schuurmiddel
- 3.2 In de vorm van gestructureerd keramiek
- 3.3 Andere toepassingen
- 4 referenties
Chemische structuur
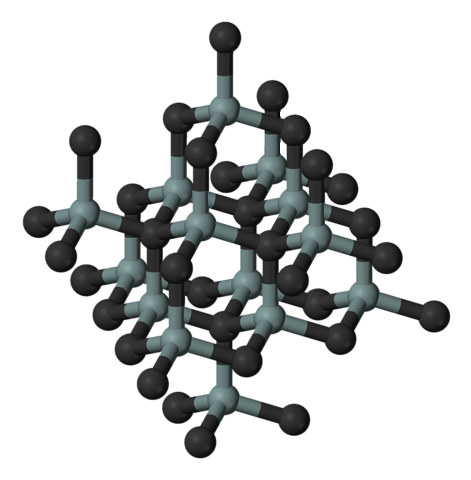
De afbeelding hierboven illustreert de kubische en kristallijne structuur van siliciumcarbide. Deze opstelling is dezelfde als die van diamant, ondanks de verschillen in atoomstralen tussen C en Si..
Alle bindingen zijn sterk covalent en directioneel, in tegenstelling tot ionische vaste stoffen en hun elektrostatische interacties.
SiC vormt moleculaire tetraëders; dat wil zeggen, alle atomen zijn aan vier andere gebonden. Deze tetraëdrische eenheden zijn met elkaar verbonden door covalente bindingen, waarbij ze gelaagde kristallijne structuren aannemen..
Deze lagen hebben ook hun eigen kristalarrangementen, die uit drie typen bestaan: A, B en C.
Dat wil zeggen, een laag A verschilt van B, en de laatste van C. Het SiC-kristal bestaat dus uit het stapelen van een reeks lagen, waarbij het fenomeen dat bekend staat als polytypisme optreedt..
Het kubische polytype (vergelijkbaar met dat van diamant) bestaat bijvoorbeeld uit een stapel ABC-lagen en heeft daarom een 3C-kristallijne structuur..
Andere stapels van deze lagen genereren ook andere structuren tussen deze rhombohedrale en hexagonale polytypes. In feite worden de kristallijne structuren van SiC uiteindelijk een "kristallijne aandoening".
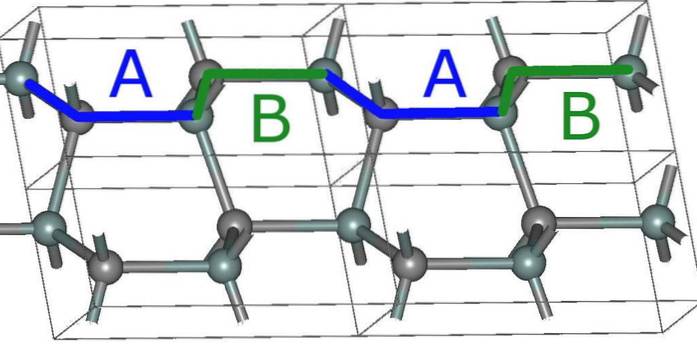
De eenvoudigste hexagonale structuur voor SiC, de 2H (bovenste afbeelding), wordt gevormd door het stapelen van de lagen met de ABABA-reeks ... Na elke twee lagen herhaalt de reeks zich, en daar komt het cijfer 2 vandaan.
Eigendommen
Algemene eigenschappen
Molaire massa
40,11 g / mol
Uiterlijk
Het varieert met de methode van verkrijgen en de gebruikte materialen. Het kan zijn: gele, groene, zwartachtig blauwe of iriserende kristallen.
Dichtheid
3,16 g / cm3
Smeltpunt
2830 ºC.
Brekingsindex
2,55.
Kristallen
Er is polymorfisme: αSiC hexagonale kristallen en βSiC kubische kristallen.
Hardheid
9 tot 10 op de schaal van Mohs.
Weerstand tegen chemische middelen
Het is bestand tegen de werking van sterke zuren en logen. Bovendien is siliciumcarbide chemisch inert..
Thermische eigenschappen
- Hoge thermische geleidbaarheid.
- Bestand tegen hoge temperaturen.
- Hoge thermische geleidbaarheid.
- Lage lineaire thermische uitzettingscoëfficiënt, dus bestand tegen hoge temperaturen met lage uitzetting.
- Bestand tegen thermische schokken.
Mechanische eigenschappen
- Hoge weerstand tegen compressie.
- Bestand tegen slijtage en corrosie.
- Het is een licht materiaal met een grote sterkte en weerstand.
- Behoudt zijn elastische weerstand bij hoge temperaturen.
Eigendommen elektrisch
Het is een halfgeleider die zijn functies kan vervullen bij hoge temperaturen en extreme spanningen, met weinig dissipatie van zijn vermogen naar het elektrische veld..
Toepassingen
Als schuurmiddel
- Siliciumcarbide is een halfgeleider die bestand is tegen hoge temperaturen, hoogspanningsgradiënten of 8 keer meer elektrische velden dan silicium. Om deze reden is het nuttig bij de constructie van diodes, transitors, onderdrukkers en hoogenergetische microgolfapparatuur..
- Lichtgevende diodes (LED's) en detectoren voor de eerste radio's (1907) werden gemaakt met de verbinding. Momenteel is siliciumcarbide bij de productie van led-lampen vervangen door galliumnitride, dat 10 tot 100 keer helderder licht afgeeft.
- In elektrische systemen wordt siliciumcarbide gebruikt als bliksemafleider in elektrische voedingssystemen, omdat ze de weerstand kunnen regelen door de spanning erover te regelen..
In de vorm van gestructureerd keramiek
- In een proces dat sinteren wordt genoemd, worden de siliciumcarbidedeeltjes - evenals die van de begeleiders - verhit tot een temperatuur die lager is dan de smelttemperatuur van dit mengsel. Het verhoogt dus de weerstand en sterkte van het keramische object door de vorming van sterke bindingen tussen de deeltjes..
- Siliciumcarbide structurele keramiek heeft een breed scala aan toepassingen gehad. Ze worden gebruikt in schijfremmen en koppelingen van motorvoertuigen, in roetfilters en als additief in oliën om wrijving te verminderen.
- Het gebruik van structurele keramiek van siliciumcarbide is wijdverbreid in onderdelen die aan hoge temperaturen worden blootgesteld. Dit is bijvoorbeeld het geval voor de keel van de raketinjectoren en de rollen van de ovens..
- De combinatie van hoge thermische geleidbaarheid, taaiheid en hoge temperatuurstabiliteit maakt componenten voor warmtewisselaarbuizen vervaardigd uit siliciumcarbide..
- Structureel keramiek wordt gebruikt in zandstraalinjectoren, auto-waterpompafdichtingen, lagers en extrusiematrijzen. Het is ook het materiaal voor smeltkroezen, gebruikt bij het smelten van metaal..
- Het maakt deel uit van de verwarmingselementen die worden gebruikt bij het smelten van glas en non-ferrometalen, evenals bij de warmtebehandeling van metalen.
Andere gebruiken
- Het kan worden gebruikt bij het meten van de temperatuur van gassen. In een techniek die bekend staat als pyrometrie, wordt een siliciumcarbide gloeidraad verwarmd en zendt straling uit die correleert met de temperatuur in een bereik van 800-2500 ºK..
- Het wordt gebruikt in kerncentrales om lekkage van materiaal geproduceerd door splijting te voorkomen.
- Bij de productie van staal wordt het gebruikt als brandstof.
Referenties
- Nicholas G. Wright, Alton B. Horsfall. Siliciumcarbide: de terugkeer van een oude vriend. Material Matters Volume 4 Article 2. Opgehaald op 5 mei 2018, van: sigmaaldrich.com
- John Faithfull. (Februari 2010). Carborundum-kristallen. Opgehaald op 5 mei 2018, van: commons.wikimedia.org
- Charles & Colvard. Polytypisme en Moissanite. Opgehaald op 5 mei 2018, van: moissaniteitalia.com
- Materiaalwetenschapper. (2014). SiC2H-structuur A. [Figuur]. Opgehaald op 5 mei 2018, van: commons.wikimedia.org
- Wikipedia. (2018). Silicium carbide. Opgehaald op 5 mei 2018, van: en.wikipedia.org
- Navarro SiC. (2018). Silicium carbide. Opgehaald op 5 mei 2018, van: navarrosic.com
- Universiteit van Barcelona. Siliciumcarbide, SiC. Opgehaald op 5 mei 2018, vanuit: ub.edu
- CarboSystem. (2018). Siliciumcarbide. Opgehaald op 5 mei 2018, van: carbosystem.com


Niemand heeft nog op dit artikel gereageerd.