
Citroenzuurstructuur, eigenschappen, productie en toepassingen
De citroenzuur is een organische verbinding die bestaat uit een zwak zuur waarvan de chemische formule C is6H.8OF7. Zoals de naam al aangeeft, is een van de belangrijkste natuurlijke bronnen citrusvruchten, en het is ook afgeleid van het Latijnse woord 'citrus', wat bitter betekent..
Het is niet alleen een zwak zuur, het is ook polyprotisch; dat wil zeggen, het kan meer dan één waterstofion afgeven, H+. Het is precies een tricarbonzuur, dus het heeft drie -COOH-groepen die H-ionen afgeven+. Elk van hen heeft zijn eigen neiging om zichzelf vrij te maken in hun omgeving..

Daarom is de structuurformule ervan beter gedefinieerd als C3H.5O (COOH)3. Dit is de chemische reden voor zijn bijdrage aan de karakteristieke smaak van bijvoorbeeld sinaasappelsegmenten. Hoewel het afkomstig is van de vruchten, werden de kristallen pas in 1784 geïsoleerd uit een citroensap in Engeland.
Het maakt ongeveer 8 massaprocent uit van sommige citrusvruchten, zoals citroenen en grapefruits. Het is ook te vinden in paprika's, tomaten, artisjokken en ander voedsel..
Artikel index
- 1 Waar wordt citroenzuur gevonden?
- 2 Structuur van citroenzuur
- 2.1 Intermoleculaire interacties
- 3 Fysische en chemische eigenschappen
- 3.1 Molecuulgewicht
- 3.2 Fysiek voorkomen
- 3.3 Smaak
- 3.4 Smeltpunt
- 3.5 Kookpunt
- 3.6 Dichtheid
- 3.7 Oplosbaarheid
- 3,8 pKa
- 3.9 Ontleding
- 3.10 Derivaten
- 4 Productie
- 4.1 Chemische of synthetische synthese
- 4.2 Natuurlijk
- 4.3 Door gisting
- 5 toepassingen
- 5.1 In de voedingsindustrie
- 5.2 In de farmaceutische industrie
- 5.3 In de cosmetische industrie en in het algemeen
- 6 Toxiciteit
- 7 referenties
Waar wordt citroenzuur gevonden?
Het wordt in kleine hoeveelheden aangetroffen in alle planten en dieren, en het is een metaboliet van levende wezens. Het is een tussenverbinding van aëroob metabolisme die aanwezig is in de tricarbonzuurcyclus of citroenzuurcyclus. In de biologie of biochemie staat deze cyclus ook bekend als de Krebs-cyclus, een amfiboolpad van metabolisme.
Behalve dat het van nature voorkomt in planten en dieren, wordt dit zuur op grote schaal synthetisch verkregen door fermentatie..
Het wordt veel gebruikt in de voedingsindustrie, in farmaceutica en chemicaliën, en het gedraagt zich als een natuurlijk conserveermiddel. Het en zijn derivaten worden massaal op industrieel niveau vervaardigd om vast en vloeibaar voedsel op smaak te brengen.
Vindt gebruik als een additief in verschillende huidschoonheidsproducten; het wordt ook gebruikt als chelaatvormer, verzurende en antioxidant. Het gebruik ervan in hoge of zuivere concentraties wordt echter niet aanbevolen; omdat het irritatie, allergieën en zelfs kanker kan veroorzaken.
Citroenzuur structuur
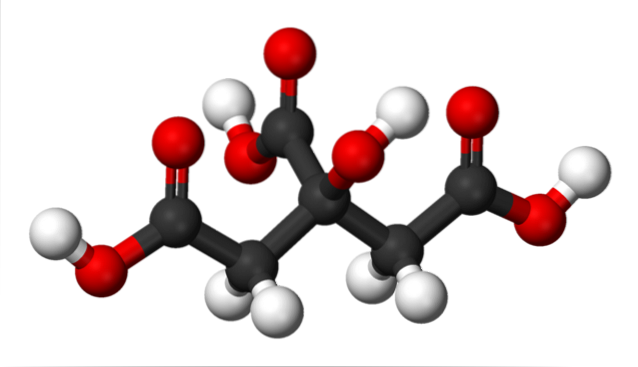
In de bovenste afbeelding is de structuur van citroenzuur weergegeven met een bolletjes- en staafjesmodel. Als je goed kijkt, kun je het skelet van slechts drie koolstofatomen vinden: propaan.
Het koolstofatoom in het midden is gekoppeld aan een groep -OH, die in aanwezigheid van carboxylgroepen, -COOH, de terminologie 'hydroxy' aanneemt. De drie -COOH-groepen zijn gemakkelijk herkenbaar aan de linker- en rechterkant en aan de bovenkant van de structuur; Hieruit komen de H vrij+.
Aan de andere kant is de -OH-groep ook in staat om een zuur proton te verliezen, dus in totaal zouden er geen drie H+, maar vier. De laatste vereist echter een aanzienlijk sterke base en dientengevolge is de bijdrage ervan aan de karakteristieke zuurgraad van citroenzuur veel minder in vergelijking met die van de -COOH-groepen..
Uit al het bovenstaande volgt dat citroenzuur ook wel 2-hydroxy-1,2,3-tricarbonpropaan genoemd kan worden.
Er is een -OH-groep in C-2, die grenst aan de -COOH-groep (kijk naar het midden bovenaan de structuur). Hierdoor valt citroenzuur ook onder de classificatie van alfa-hydroxyzuren; waarbij alfa 'aangrenzend' betekent, dat wil zeggen, er is slechts één koolstofatoom dat de -COOH en -OH scheidt.
Intermoleculaire interacties
Zoals te zien is, heeft de citroenzuurstructuur een hoge capaciteit om waterstofbruggen te doneren en te accepteren. Dit maakt het erg verwant aan water, en ook de reden waarom het heel gemakkelijk een monohydraat vaste, rhombohedrale kristallen vormt..
Deze waterstofbruggen zijn ook verantwoordelijk voor het oprichten van de kleurloze monokliene kristallen van citroenzuur. Watervrije kristallen (zonder water) kunnen worden verkregen na vorming in heet water, gevolgd door volledige verdamping..
Fysische en chemische eigenschappen
Molecuulgewicht
210,14 g / mol.
Fysiek uiterlijk
Kleurloze en reukloze zure kristallen.
Smaak
Zuur en bitter.
Smeltpunt
153 ° C.
Kookpunt
175 ° C.
Dichtheid
1,66 g / ml.
Oplosbaarheid
Het is een zeer goed oplosbare verbinding in water. Het is ook zeer oplosbaar in andere polaire oplosmiddelen zoals ethanol en ethylacetaat. In apolaire en aromatische oplosmiddelen zoals benzeen, tolueen, chloroform en xyleen is het onoplosbaar.
pKa
-3.1
-4.7
-6.4
Dit zijn de pKa-waarden voor elk van de drie -COOH-groepen. Merk op dat de derde pKa (6,4) nauwelijks licht zuur is, dus het dissocieert weinig.
Ontleding
Bij extreme temperaturen of boven 175 ° C ontleedt het waarbij CO vrijkomttwee en water. Daarom komt de vloeistof niet significant aan de kook omdat deze eerst ontleedt..
Derivaten
Als je H verliest+, andere kationen nemen hun plaats in, maar op een ionische manier; dat wil zeggen, de negatieve ladingen van de -COO-groepen- trekken andere soorten positieve ladingen aan, zoals Na+. Hoe meer gedeprotoneerd het citroenzuur is, hoe meer kationen de derivaten ervan, citraten genaamd, zullen hebben.
Een voorbeeld is natriumcitraat, dat een zeer nuttige chelerende werking heeft als stollingsmiddel. Deze citraten kunnen daarom complexen vormen met metalen in oplossing..
Aan de andere kant is de H+ van de -COOH-groepen kunnen zelfs worden vervangen door andere covalent gekoppelde soorten, zoals R-zijketens, waardoor citraatesters ontstaan: C3H.5OF (COOR)3.
De diversiteit is erg groot, aangezien niet alle H noodzakelijkerwijs vervangen hoeft te worden door R, maar ook door kationen.
Productie
Citroenzuur kan op natuurlijke wijze worden geproduceerd en commercieel worden verkregen door de fermentatie van koolhydraten. De productie ervan is ook synthetisch uitgevoerd door middel van chemische processen die tegenwoordig niet erg actueel worden gehouden..
Er zijn verschillende biotechnologische processen gebruikt voor de productie ervan, omdat er wereldwijd veel vraag is naar deze verbinding.
Chemische of synthetische synthese
-Een van deze chemische syntheseprocessen wordt onder hoge druk uitgevoerd uit calciumzouten van isocitraat. Het sap dat uit citrusvruchten wordt gewonnen, wordt behandeld met calciumhydroxide en er wordt calciumcitraat verkregen..
Dit zout wordt vervolgens geëxtraheerd en omgezet met een verdunde zwavelzuuroplossing, waarvan de functie is om het citraat te protoneren tot zijn oorspronkelijke zuurvorm..
-Citroenzuur is ook gesynthetiseerd uit glycerine door de componenten ervan te vervangen door een carboxylgroep. Zoals zojuist vermeld, zijn deze processen niet optimaal voor grootschalige citroenzuurproductie..
natuurlijk
In het lichaam komt citroenzuur van nature voor in het aërobe metabolisme: de tricarbonzuurcyclus. Wanneer acetylco-enzym A (acetyl-CoA) de cyclus binnengaat, bindt het zich met oxaalazijnzuur en vormt het citroenzuur..
En waar komt acetyl-CoA vandaan?
In de reacties van het katabolisme van vetzuren, koolhydraten, onder andere substraten, in aanwezigheid van Otwee acetyl-CoA wordt geproduceerd. Dit wordt gevormd als een product van de bèta-oxidatie van vetzuren, van de omzetting van pyruvaat gegenereerd in glycolyse.
Citroenzuur gevormd in de Krebs-cyclus of citroenzuurcyclus zal worden geoxideerd tot alfa-ketoglutaarzuur. Dit proces vertegenwoordigt een amfibolische oxidatie-reductie route, waaruit equivalenten worden gegenereerd die vervolgens energie of ATP zullen produceren..
De commerciële productie van citroenzuur als tussenproduct in het aëroob metabolisme was echter evenmin winstgevend of bevredigend. Alleen onder omstandigheden van organische onbalans kan de concentratie van deze metaboliet worden verhoogd, wat niet levensvatbaar is voor micro-organismen.
Door gisting
Micro-organismen, zoals schimmels en bacteriën, produceren citroenzuur door suikers te fermenteren.
De productie van citroenzuur uit microbiële fermentatie heeft betere resultaten opgeleverd dan het verkrijgen door chemische synthese. Er zijn onderzoekslijnen ontwikkeld met betrekking tot deze commerciële massaproductiemethode, die grote economische voordelen heeft geboden..
Teelttechnieken op industrieel niveau zijn in de loop van de tijd gevarieerd. Er zijn culturen voor fermentatie aan het oppervlak en ondergedompeld. Ondergedompelde culturen zijn culturen waarin micro-organismen fermentatie produceren van substraten die zich in vloeibare media bevinden.
De productieprocessen van citroenzuur door ondergedompelde fermentatie, die plaatsvindt onder anaerobe omstandigheden, zijn optimaal verlopen..
Sommige paddenstoelen houden van Aspergillus niger, Saccahromicopsis sp, en bacteriën zoals Bacillus licheniformis, hebben het mogelijk gemaakt om een hoge opbrengst te behalen met dit type fermentatie.
Paddestoelen zoals Aspergillus niger of candida sp, Ze produceren citroenzuur als resultaat van de fermentatie van melasse en zetmeel. Onder andere rietsuiker, maïs en bietsuiker worden ook gebruikt als fermentatiesubstraten..
Toepassingen
Citroenzuur wordt veel gebruikt in de voedingsindustrie, bij de vervaardiging van farmaceutische producten. Het wordt ook gebruikt in talloze chemische en biotechnologische processen..
In de voedingsindustrie
-Citroenzuur wordt voornamelijk in de voedingsindustrie gebruikt omdat het een aangename zure smaak geeft. Het is zeer oplosbaar in water, dus het wordt toegevoegd aan dranken, snoep, snoep, gelei en bevroren fruit. Het wordt ook gebruikt bij de bereiding van wijnen, bieren en andere dranken..
-Naast het toevoegen van een zure smaak, inactiveert het sporenelementen die bescherming bieden aan ascorbinezuur of vitamine C. Het werkt ook als emulgator in roomijs en kazen. Draagt bij aan de inactivering van oxidatieve enzymen door de pH van voedsel te verlagen.
-Verhoogt de effectiviteit van conserveermiddelen die aan voedsel worden toegevoegd. Door een relatief lage pH te bieden, verkleint het de kans dat micro-organismen overleven in bewerkte voedingsmiddelen, waardoor hun houdbaarheid toeneemt..
-In vetten en oliën wordt citroenzuur gebruikt om het synergetische antioxiderende effect (van alle vetcomponenten) dat dit soort voedingsstoffen kan hebben, te versterken..
In de farmaceutische industrie
-Citroenzuur wordt ook veel gebruikt als hulpstof in de farmaceutische industrie om de smaak en het oplossen van medicijnen te verbeteren..
-In combinatie met bicarbonaat wordt citroenzuur toegevoegd aan poedervormige en tabletproducten op een manier die werkt als een bruisend.
-De zouten van citroenzuur maken het gebruik ervan als antistollingsmiddel mogelijk, omdat het calcium kan cheleren. Citroenzuur wordt toegediend in minerale supplementen zoals citraatzouten.
-Door het medium van het absorptieproces op darmniveau aan te zuren, optimaliseert citroenzuur de opname van vitamines en sommige medicijnen. De watervrije vorm wordt toegediend als aanvulling op andere geneesmiddelen bij het oplossen van stenen.
-Het wordt ook gebruikt als een zuurteregelaar, samentrekkend middel, als een middel dat het oplossen van de actieve ingrediënten van verschillende farmaceutische producten vergemakkelijkt..
In de cosmetische industrie en in het algemeen
-Citroenzuur wordt gebruikt als chelaatvormer voor metaalionen in toiletartikelen en cosmetica..
-Het wordt gebruikt voor het reinigen en polijsten van metalen in het algemeen, waarbij het oxide dat ze bedekt verwijdert.
-Bij lage concentraties dient het als additief in ecologische reinigingsproducten, die goed zijn voor het milieu en de natuur..
-Het heeft een breed scala aan toepassingen: het wordt gebruikt in fotografische reagentia, textiel, bij het looien van leer.
-Voegt toe aan drukinkten.
Toxiciteit
Meldingen over de toxiciteit ervan worden in verband gebracht met onder andere een hoge concentratie citroenzuur, blootstellingstijd, onzuiverheden..
Citroenzuuroplossingen die worden verdund, vormen geen enkel risico of gevaar voor de gezondheid. Zuiver of geconcentreerd citroenzuur vormt echter een veiligheidsrisico en mag daarom niet worden geconsumeerd..
Puur of geconcentreerd, het is bijtend en irriterend bij contact met de huid en slijmvliezen van de ogen, neus en keel. Kan bij inslikken allergische huidreacties en acute toxiciteit veroorzaken..
Inademing van zuiver citroenzuurstof kan ook het slijmvlies van de luchtwegen aantasten. Inademing kan kortademigheid, allergieën, sensibilisatie van het ademhalingsslijmvlies veroorzaken en kan zelfs astma veroorzaken.
Er zijn reproductietoxische effecten gemeld. Citroenzuur kan genetische defecten veroorzaken en mutaties in geslachtscellen veroorzaken.
En tot slot wordt het als gevaarlijk of giftig voor de waterhabitat beschouwd, en in het algemeen is geconcentreerd citroenzuur corrosief voor metalen..
Referenties
- BellChem (21 april 2015). Het gebruik van citroenzuur in de voedingsindustrie. Hersteld van: bellchem.com
- Vandenberghe, Luciana P.S, Soccol, Carlos R, Pandey, Ashok en Lebeault, Jean-Michel. (1999). Microbiële productie van citroenzuur. Braziliaanse archieven voor biologie en technologie, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Citroenzuur. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Citroenzuur. Hersteld van: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. en Stanley, G. (2008). Chemie. (8ava. ed). CENGAGE Leren: Mexico.
- Berovic, M. en Legisa, M. (2007). Citroenzuurproductie. Biotechologie jaaroverzicht. Hersteld van: researchgate.net



Niemand heeft nog op dit artikel gereageerd.