
Galluszuur structuur, eigenschappen, verkrijgen, gebruik

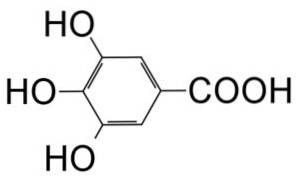
De galluszuur is een organische verbinding met molecuulformule C6H.twee(OH)3COOH dat behoort tot de categorie polyfenolen. Het wordt herkend als een kristallijn poeder met een witte kleur die bijna bleekgeel is..
Het is een trihydroxybenzoëzuur dat wordt gevormd door een benzeenring waaraan een carbonzuurgroep (-COOH) en 3 hydroxylgroepen (-OH) op posities 3, 4 en 5 van de ring zijn bevestigd..
In de natuur wordt het op grote schaal verspreid, omdat het een product is dat in aanzienlijke hoeveelheden wordt gevormd in planten en schimmels. Het bestaat gratis of gehecht aan de tannines van de meeste plantensoorten, waar walnoten, druiven, divi-divi-planten, eikenbast, granaatappel of zijn wortels, sumakplanten en thee opvallen..

Het wordt ook aangetroffen in honing, cacao, verschillende bessen, mango en andere soorten fruit en groenten, en in sommige dranken zoals wijn- en thee-infusies..
In plantenweefsels heeft het de vorm van een ester of gallaat. De hoeveelheid waarin het wordt aangetroffen, is afhankelijk van externe prikkels, zoals de hoeveelheid UV-straling die de plant heeft ontvangen, chemische stress en microbiële infecties..
In het geval van druiven en wijn hangt het af van de druivensoort, verwerking en opslag. In groene thee is het gehalte aan gallaten hoog, maar cacao bevat meer dan groene thee en rode wijn.
Chemisch gedraagt het zich als een reductiemiddel. Het is samentrekkend en antioxidant. Het is ook gebruikt in blauwe schrijfinkt en wordt veel gebruikt in de farmaceutische industrie..
Het heeft een groot potentieel voor medische toepassingen, aangezien het door de vele eigenschappen van galluszuur en zijn derivaten een veelbelovend therapeutisch middel is in de preventieve geneeskunde..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3.6 Dissociatieconstante
- 3.7 Chemische eigenschappen
- 3.8 Overige eigenschappen
- 4 Verkrijgen
- 5 toepassingen
- 5.1 - In inkt en kleurstoffen
- 5.2 - In medische toepassingen
- 5.3 - In mogelijke medische toepassingen
- 5.4 - Bij diergeneeskundig gebruik
- 5.5 - In verschillende toepassingen
- 5.6 - Bruikbaarheid in natuurlijke aquatische omgevingen
- 6 referenties
Structuur
Galluszuur kristalliseert uit absolute methanol of uit chloroform in de vorm van witte naalden. Kristalliseert in water in de vorm van zijdeachtige naalden uit zijn monohydraat.
Nomenclatuur
- galluszuur.
- 3,4,5-trihydroxybenzoëzuur.
Eigendommen
Fysieke toestand
Stevige, kristallijne naalden.
Molecuulgewicht
170,12 g / mol.
Smeltpunt
Het ontleedt bij 235-240 ºC en genereert pyrogallol en COtwee
Dichtheid
1,694 g / cm3
Oplosbaarheid
In water: matig oplosbaar.
- 1 g in 87 ml water
- 1 g in 3 ml kokend water
In ethanol: 1 g in 6 ml alcohol.
In diethylether: 1 g in 100 ml ether.
In glycerol: 1 g in 10 ml glycerol.
In aceton: 1 g in 5 ml aceton.
Vrijwel onoplosbaar in benzeen, chloroform en petroleumether.
Dissociatieconstante
K1 4,63 x 10-3 (bij 30 ºC).
Ktwee 1,41 x 10-9
Chemische eigenschappen
Galluszuuroplossingen, met name alkalimetaalzouten, absorberen zuurstof en worden bruin bij blootstelling aan lucht.
Galluszuur is een sterk reductiemiddel dat goud- of zilverzouten tot het metaal kan reduceren. Het is onverenigbaar met chloraten, permanganaat, ammoniak, loodacetaat, alkalihydroxiden, alkalicarbonaten, zilverzouten en oxidatiemiddelen in het algemeen..
Met ijzer (II) zouten vormt galluszuur een diepblauw complex.
In galluszuur is de hydroxylgroep (-OH) op positie 4 het chemisch meest reactief.
Andere eigenschappen
Het moet tegen licht worden beschermd omdat het fotochemisch wordt afgebroken.
Het is een licht lokaal irriterend middel. Inademing van stof kan de neus en keel aantasten en contact met ogen en huid veroorzaakt irritatie..
Toxiciteitsstudies bij muizen geven aan dat galluszuur bij inname tot een niveau van 5000 mg / kg niet giftig is voor deze dieren. Het wordt als een lage toxiciteit beschouwd en bevestigt de veiligheid van het gebruik.
Het verkrijgen van
Galluszuur wordt verkregen door alkalische of zure hydrolyse van de tannines van noten of plantaardig materiaal dat rijk is aan deze verbindingen..
Hydrolyse kan ook enzymatisch worden uitgevoerd met behulp van kweekbouillons, zoals Penicillium glaucum of de Aspergillus niger, die tannase bevatten, een enzym dat het tanninemolecuul breekt of splitst.
Een andere manier om galluszuur te verkrijgen is uit p-hydroxybenzoëzuur, door sulfonering en alkalische fusie, waarmee de toevoeging van de andere twee -OH-groepen in het molecuul wordt bereikt..
Toepassingen
- In inkten en kleurstoffen
Galluszuur wordt gebruikt bij de vervaardiging van anthragalol en pyrogallol, die tussenpersonen zijn bij de productie van kleurstoffen, zoals gallocyanine en galoflavine. Het is op zijn beurt een grondstof voor de synthese van oxazinederivaten, die ook als kleurstof worden gebruikt..
Omdat het een blauw complex vormt met ijzer, is galluszuur erg belangrijk bij de productie van schrijfinkt. Deze inkten bevatten voornamelijk een mengsel van galluszuur, ferrosulfaat (FeSO4) en Arabische gom.
IJzer-galluszuurinkten zijn onmisbare materialen geweest voor het schrijven van documenten, het tekenen van plannen en het voorbereiden van geschreven materiaal..

- In medische toepassingen
Het wordt gebruikt als een samentrekkend middel in de darmen en als een middel om bloedingen te stoppen (bloedstelpend). Galluszuur is de grondstof voor het verkrijgen van rufigalol, een middel tegen malaria..
Vanwege het chemisch reducerende vermogen wordt galluszuur gebruikt bij de vervaardiging van farmaceutische producten..
- In mogelijke medische toepassingen
Tegen kanker
Galluszuur is geïdentificeerd als de belangrijkste verantwoordelijke voor de kankerbestrijdende eigenschappen van verschillende plantenextracten.
In tegenstelling tot zijn specifieke antioxiderende werking, is gevonden dat het pro-oxiderende eigenschappen kan vertonen bij de inductie van apoptose van kankercellen. Apoptose is de ordelijke vernietiging van beschadigde cellen veroorzaakt door hetzelfde organisme.
Er zijn aanwijzingen dat galluszuur en gallaten selectieve apoptose induceren in snelgroeiende tumorcellen, waardoor gezonde cellen intact blijven. Bovendien is gemeld dat het de angiogenese vertraagt, en bijgevolg de invasie en uitzaaiing van kanker.
Galluszuur-antikankeractiviteit is gevonden bij leukemie, prostaat-, long-, maag-, pancreas- en colonkanker, borst-, baarmoederhals- en slokdarmkanker.
Tegen verschillende pathologieën
In verschillende onderzoeken is aangetoond dat het een antischimmel-, antibacteriële, antivirale, anti-allergische, ontstekingsremmende, antimutagene, anti-cholesterol-, anti-obesitas- en immunomodulerende werking heeft..
Galluszuur is een goede kandidaat voor het beheersen van parodontitis (tandvleesaandoeningen).
Het vertoont ook neuroprotectieve, cardioprotectieve, hepatoprotectieve en nefroprotectieve mogelijkheden. Verschillende onderzoeken naar hartweefsel bij ratten hebben bijvoorbeeld bevestigd dat galluszuur een beschermend effect heeft op het myocardium tegen oxidatieve stress..
Als cellulair antiverouderingsmiddel
Galluszuur biedt efficiënte bescherming tegen oxidatieve schade veroorzaakt door reactieve soorten die vaak in biologische systemen voorkomen, zoals hydroxylradicalen (OH.), superoxide (Otwee.) en peroxyl (ROO..
Het is gebleken dat het sneller door het spijsverteringskanaal wordt opgenomen dan de meeste polyfenolen. En het is er een met de hoogste antioxidantcapaciteit.
Bovendien beweren sommige onderzoekers dat galluszuur kan worden getransporteerd door niosomen om de antiverouderingsactiviteit te verhogen. Het niosoom is een moleculair systeem voor de gecontroleerde afgifte van medicijnen op de plaats van het lichaam dat het nodig heeft.
Deze eigenschappen geven het een hoog potentieel tegen celveroudering..
- Bij veterinair gebruik
Het is gebruikt als een samentrekkend middel in de darmen bij dieren.
- In verschillende toepassingen
Galluszuur wordt gebruikt bij de vervaardiging van zijn esters, zoals methylgallaat, propylgallaat, octylgallaat en laurylgallaat..
Deze derivaten worden veel gebruikt als antioxidanten en conserveermiddelen in bewerkte voedingsmiddelen, in voedselverpakkingsmaterialen, om ranzig worden en oxidatieve achteruitgang te voorkomen. De genoemde derivaten worden ook in cosmetica gebruikt.
Galluszuur wordt gebruikt als fotografische ontwikkelaar en bij de vervaardiging van papier. Bovendien wordt het op grote schaal gebruikt bij de stabilisatie van collageen in het leerlooiproces..
Als analytisch reagens is galluszuur ideaal als standaard voor het bepalen van het fenolgehalte van plantenextracten, en de resultaten worden uitgedrukt als galluszuurequivalenten..
Het wordt ook gebruikt in tests voor de bepaling van vrije minerale zuren, dihydroxyaceton en alkaloïden..
- Bruikbaar in natuurlijke wateromgevingen
Galluszuur, dat van nature aanwezig is in watervoerende lagen in plantaardig materiaal, is een van de bronnen die verantwoordelijk zijn voor de beschikbaarheid van Fe (II) uit de voedingswaarde die nodig is voor de groei van aquatische soorten.
Dit komt omdat het in staat is om onder aërobe omstandigheden hoge concentraties opgelost ijzer (II) te handhaven. Dit komt omdat het een complex vormt met Fe (II) dat bestand is tegen oxidatie..

Referenties
- Sajid, M. et al. (2019). Op nanodeeltjes gebaseerde levering van fytomedicijnen: uitdagingen en kansen. In New Look to Phytomedicine. Hoofdstuk 23. Hersteld van sciencedirect.com.
- Windholz, M.; Budavari, S.; Blumetti, R. F. en Otterbein, E. (redactie) (1983). De Merck Index. Tiende editie. Merck & CO., Inc.
- CRC Handbook of Chemistry and Physics. 75th 1994. CRC Press, Inc.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. Deel A13. VCH Verlagsgesellschaft mbH.
- Badhani, B; Sharma, N. en Kakkar, R. (2015). Galluszuur: een veelzijdige antioxidant met veelbelovende therapeutische en industriële toepassingen. RSC-vorderingen. Opgehaald van rsc.org.
- Zanwar, Anand A., et al. (2014). De rol van galzuur bij cardiovasculaire aandoeningen. In polyfenolen in menselijke gezondheid en ziekte. Hoofdstuk 80. Hersteld van sciencedirect.com.
- Nowak, R. et al. (2014). Plant polyfenolen als chemopreventieve middelen. In polyfenolen in menselijke gezondheid en ziekte. Hoofdstuk 97. Hersteld van sciencedirect.com.



Niemand heeft nog op dit artikel gereageerd.