
Sterke en zwakke zuren en basen

Een classificatie van zuren en basen in de chemie hangt af van de ionisatiekracht van deze stoffen in waterig medium. A) Ja:
- een zuur en een base zijn sterk wanneer ze volledig geïoniseerd zijn, dat wil zeggen, tijdens het ionisatieproces worden ze volledig omgezet in kationen of positieve ionen en in anionen of negatieve ionen.
- Aan de andere kant, een zuur en een base zijn zwak wanneer ze gedeeltelijk geïoniseerd zijn in water, dat wil zeggen, in oplossing zal er een deel van kationen zijn, een ander deel van anionen en een ander deel van niet-gedissocieerde moleculen.
| Sterke zuren en basen | Zwakke zuren en basen | |
|---|---|---|
| Definitie | Stoffen die in oplossing volledig ioniseren. | Stoffen die gedeeltelijk ioniseren in oplossing. |
| Ionisatie | Compleet | Gedeeltelijk |
| Elementen in waterige oplossing | Kationen en anionen in dezelfde concentratie. | Kationen, anionen en moleculen in verschillende verhoudingen. |
| Ionisatie constant | Verhoogd | Weinig |
| Voorbeelden |
|
|
Sterke zuren en basen
EEN zuur of een base zijn sterk wanneer ze in een waterig medium volledig dissociëren, dat wil zeggen, het ionisatieproces is voltooid en de oplossing zal dezelfde concentratie anionen hebben als kationen.
Hoe ioniseer je een zuur en een sterke base??
Een sterk zuur, zoals zoutzuur HCl, ioniseert op de volgende manieren:
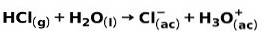
Een sterke base, zoals natriumhydroxide NaOH, ioniseert op de volgende manieren:
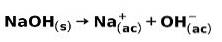
Voorbeelden van sterke zuren en hun formules
| Sterke zuren | Formule |
|---|---|
| Zoutzuur | HCl |
| Zwavelzuur | H.tweeSW4 |
| Salpeterzuur | HNO3 |
| Broomwaterstofzuur | HBr |
| Perchloorzuur | HClO4 |
| Chroomzuur | H.tweeCrO4 |
| Tetrafluroboorzuur | HBF4 |
Voorbeelden van sterke basen en hun formules
| Sterke basis | Formule |
|---|---|
| Natriumhydroxide | NaOH |
| Lithiumhydroxide | LiOH |
| Kaliumhydroxide | KOH |
| Rubidium hydroxide | RbOH |
| Cesium hydroxide | CsOH |
| Calcium hydroxide | Ca (OH)twee |
| Bariumhydroxide | Ba (OH)twee |
| Strontiumhydroxide | Sr (OH)twee |
| Aluminiumhydroxide | Al (OH)3 |
Mogelijk bent u geïnteresseerd in meer voorbeelden van zuren en basen.
Zwakke zuren en basen
EEN Zuur of base is zwak wanneer gedeeltelijk geïoniseerd in waterige oplossing, dat wil zeggen, in de oplossing zijn er ionen en niet-geïoniseerde moleculen.
Hoe ioniseer je een zuur en een zwakke base??
Een zwak zuur, zoals azijnzuur CH3COOH, wordt op de volgende manier geïoniseerd:
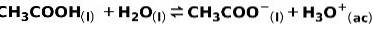
Het evenwicht van deze reactie wordt uitgedrukt door de twee pijlen in tegengestelde richtingen.
Wanneer een zwak zuur dissocieert of ioniseert, wordt een evenwicht tot stand gebracht tussen de soorten die in de oplossing aanwezig zijn; dit kan worden uitgedrukt door een ionisatieconstante zuur
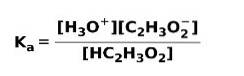
De ionisatieconstante is niets meer dan de verhouding tussen de vermenigvuldiging van de concentratie van de producten en de vermenigvuldiging van de concentratie van de reactanten.
Een zwakke base, zoals NH-ammoniak3, ioniseert op de volgende manier:
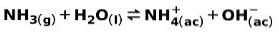
Wanneer een zwakke base dissocieert of ioniseert, wordt een evenwicht tot stand gebracht tussen de soorten die in de oplossing aanwezig zijn; dit kan worden uitgedrukt door een basis ionisatie constante
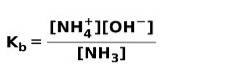
Misschien ben je geïnteresseerd in het verschil tussen zuren en basen.
Voorbeelden van zwakke zuren met hun formule en zuurionisatieconstante Knaar
| Zwak zuur | Formule | Ionisatie constant |
|---|---|---|
| Mierenzuur | H.tweeCOtwee | 1,77 x 10-4 |
| Azijnzuur | H.3CCOH | 1,75 x 10-5 |
| Blauwzuur | HOCN | 3,30 x 10-4 |
| Waterstofcyanide | HCN | 6,20 x 10-10 |
| Hypochloorzuur | HOCl | 3,50 x 10-8 |
| Salpeterig zuur | HNOtwee | 4,00 x 10-4 |
| Melkzuur | HC3H.5OF3 | 1,40 x 10-4 |
| Koolzuur | H.tweeCO3 | 4,30 x 10-7 5,60 x 10-elf |
| Boorzuur | H.3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Voorbeelden van zwakke basen met hun formule en basisionisatieconstante Kb
| Zwakke basis | Formule | Ionisatie constant |
|---|---|---|
| Ammoniak | NH3 | 1,75 x 10-5 |
| Methylamine | CH3NHtwee | 4,38 x 10-4 |
| Ethylamine | CtweeH.5NHtwee | 5,60 x 10-4 |
| Aniline | C6H.5NHtwee | 3,80 x 10-10 |
| Pyridine | C5H.5N | 1,70 x 10-9 |
| Benzylamine | C7H.9N | 2,20 x 10-5 |
| Natriumbicarbonaat | NaHCO | 2,00 x 10-4 |
Mogelijk bent u geïnteresseerd in meer informatie over de kenmerken van zuren en basen



Niemand heeft nog op dit artikel gereageerd.