
Hexokinase-structuren, functies, vormen

De hexokinase (HK) is het enzym dat de eerste reactie van de glycolytische route katalyseert in vrijwel alle levende organismen, zowel prokaryoten als eukaryoten. Het is verantwoordelijk voor de overdracht van een fosforylgroep naar glucose en produceert glucose-6P, hoewel het ook andere suikers kan fosforyleren hexosen (6 koolstofatomen).
Dit enzym is ingedeeld in een van de twee families van glucosekinase-enzymen (enzymen die fosforylgroepen overbrengen naar substraten zoals glucose): de hexokinase (HK) -familie, waarvan de leden zijn onderverdeeld in drie verschillende groepen die bekend staan als de HK-groep, de groep A en groep B.
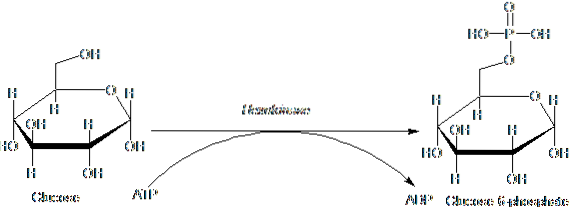
De enzymen die tot de HK-familie behoren, worden gekenmerkt door het fosforyleren van glucose ten koste van ATP als een fosforylgroepdonormolecuul, en de leden ervan verschillen onderling voornamelijk met betrekking tot hun molecuulgewicht en substraatspecificiteit..
De HK-groep omvat de enzymen van eukaryote organismen (ATP: D-hexose 6-fosfotransferasen), terwijl groep A wordt vertegenwoordigd door de enzymen van gramnegatieve bacteriën, cyanobacteriën, amitochondriënten protisten en trypanosomatiden, en groep B bevat de enzymen grampositief bacteriën en crenokotische organismen.
Groep A- en B-enzymen staan ook bekend als glucokinasen (GlcK's), omdat ze uitsluitend glucose kunnen fosforyleren, daarom worden deze enzymen ATP: D-glucose 6-fosfotransferasen genoemd..
Als glycolytisch enzym heeft hexokinase een groot metabolisch belang, aangezien deze belangrijke route zonder dit niet mogelijk zou zijn en cellen die sterk afhankelijk zijn van koolhydraatconsumptie, zoals de hersenen en spiercellen van veel zoogdieren, in het algemeen ernstige functionele en fysiologische belemmeringen zouden hebben..
Artikel index
- 1 Structuur
- 2 functies
- 2.1 In planten
- 3 vormen
- 4 referenties
Structuur
Zoals later zal worden gezien, bestaan er verschillende soorten hexokinase-enzymen in zoogdieren en andere gewervelde dieren (evenals in eencellige organismen zoals gist). Bij zoogdieren zijn er vier beschreven: isovormen I, II, III en IV.
De eerste drie isozymen hebben een molecuulgewicht van 100 kDa, maar isozym IV heeft een molecuulgewicht van 50 kDa. Deze iso-enzymen (vooral I-III) vertonen een hoge sequentie-overeenkomst tussen hen met betrekking tot hun C- en N-termini, evenals met andere leden van de hexokinasefamilie..
Het N-terminale domein van deze enzymen wordt beschouwd als het "regulerende" domein, terwijl de katalytische activiteit wordt uitgevoerd door het C-terminale domein (zoogdier HK II heeft actieve sites in beide domeinen).
Het N-terminale domein is via een alfa-helix verbonden met het C-terminale domein, elk heeft een molecuulgewicht van ongeveer 50 kDa en heeft een bindingsplaats voor glucose.
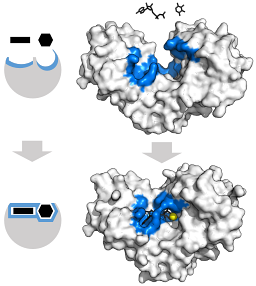
De tertiaire structuur van deze enzymen is in wezen samengesteld uit β-gevouwen vellen gemengd met alfa-helices, waarvan het aandeel varieert met betrekking tot het enzym en de soort in kwestie; de bindingsplaats voor ATP, het andere substraat voor hexokinase, bestaat gewoonlijk uit vijf β-vellen en twee alfa-helices.
Kenmerken
Hexokinase heeft een transcendentale functie in het koolhydraatmetabolisme van de meeste levende wezens, aangezien het de eerste stap van de glycolytische route katalyseert en de fosforylering van glucose in de cel medieert..
Deze eerste stap van glycolyse, die bestaat uit de overdracht van een fosforylgroep van ATP (donor) naar glucose, wat glucose 6-fosfaat en ADP oplevert, is de eerste van de twee energie-investeringsstappen in de vorm van ATP..
Bovendien is de reactie die wordt gekatalyseerd door hexokinase de stap van "activering" van glucose voor de daaropvolgende verwerking en vertegenwoordigt een stap van "toewijding", aangezien de aldus gefosforyleerde glucose de cel niet kan verlaten door middel van zijn conventionele transporteurs in het membraan..
Het product van de reactie dat wordt gekatalyseerd door hexokinase, dat wil zeggen glucose-6-fosfaat, is een vertakkingspunt, aangezien het het eerste substraat is dat wordt gebruikt in de pentosefosfaatroute en bij de synthese van glycogeen bij veel dieren (en het zetmeel in planten).
In de planten
De functie van hexokinase in planten verschilt niet veel van die van dieren of micro-organismen, maar bij hogere planten functioneert dit enzym ook als een "sensor" voor de concentratie van suikers..
Het belang van deze functie in deze organismen heeft te maken met de deelname van suikers als regulerende factoren bij de expressie van genen die betrokken zijn bij verschillende metabolische processen, zoals:
- Fotosynthese
- De glyoxylaatcyclus
- De ademhaling
- De afbraak of synthese van zetmeel en sucrose
- Stikstofstofwisseling
- Verdediging tegen ziekteverwekkers
- Regulatie van de celcyclus
- De genezende reactie
- Pigmentatie
- Senescentie, onder anderen.
Deze functie van hexokinase als een "sensor" van de hoeveelheid intracellulaire glucose is ook beschreven voor gist en zoogdieren..
Vormen
In de natuur zijn er verschillende vormen van hexokinases en dit hangt fundamenteel af van de soort die wordt overwogen.
Bij mensen en andere gewervelde dieren is bijvoorbeeld het bestaan van 4 verschillende isovormen van het hexokinase-enzym in het cytosolische compartiment aangetoond, die zijn aangegeven met de Romeinse cijfers I, II, III en IV.
Isoenzymen I, II en III hebben een molecuulgewicht van 100 kDa, worden geremd door hun reactieproduct (glucose-6-fosfaat) en zijn sterk glucosegerelateerd, dat wil zeggen, ze hebben een zeer lage Km-constante. Deze enzymen hebben echter een slechte substraatspecificiteit, omdat ze andere hexosen zoals fructose en mannose kunnen fosforyleren..
Isoenzym IV, ook bekend als glucokinase (GlcK), heeft een molecuulgewicht van slechts 50 kDa en, ondanks het feit dat het slecht verwant is (hoge Km-waarden), heeft het een hoge specificiteit voor glucose als substraat en is het er niet aan onderworpen. de andere drie iso-enzymen.
Glucokinase (iso-enzym IV van de hexokinase van veel zoogdieren) wordt voornamelijk in de lever aangetroffen en helpt dit orgaan bij de "aanpassing" van zijn glucoseverbruik als reactie op variaties van dit substraat in het circulerende bloed..
De drie genen die coderen voor hexokinases I, II en III bij dieren lijken dezelfde 50 kDa voorouder te hebben die werd gedupliceerd en gefuseerd in het genoom, wat duidelijk lijkt wanneer wordt waargenomen dat de katalytische activiteit van de vormen I en III alleen aanwezig is op het C-terminale uiteinde.
Referenties
- Aronoff, S. L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Glucosemetabolisme en -regulatie: verder dan insuline en glucagon. Diabetes spectrum, 17(3), 183-190.
- Harrington, G. N., en Bush, D. R. (2003). De bifunctionele rol van hexokinase in metabolisme en glucose-signalering. De plantencel, vijftien(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L., & Sheen, J. (1997). Hexokinase als suikersensor in hogere planten. De plantencel, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypothese: structuren, evolutie en voorouder van glucosekinasen in de hexokinasefamilie. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biochemie.
- Wilson, J. E. (2003). Isozymen van hexokinase van zoogdieren: structuur, subcellulaire lokalisatie en metabolische functie. Journal of Experimental Biology, 206(12), 2049-2057.


Niemand heeft nog op dit artikel gereageerd.