
Darmstadtium ontdekking, structuur, eigenschappen, gebruik

De darmstadtium Het is een ultrazwaar chemisch element dat zich in de transactinide-reeks bevindt, dat net na het lawrence-metaal begint. Het bevindt zich specifiek in groep 10 en periode 7 van het periodiek systeem, zijnde verwanten van de metalen nikkel, palladium en platina.
Het chemische symbool is Ds, met een atoomnummer van 110, en de weinige atomen die zijn gesynthetiseerd, vallen praktisch onmiddellijk uiteen. Het is daarom een kortstondig element. Het synthetiseren en detecteren ervan was een prestatie in de jaren negentig, waarbij een groep Duitse onderzoekers de eer opeiste voor de ontdekking ervan..

Voordat het werd ontdekt en wat de naam zou moeten worden besproken, had het IUPAC-nomenclatuursysteem het formeel 'ununilio' genoemd, wat 'één-één-nul' betekent, gelijk aan 110. En verder terug van deze nomenclatuur, volgens het Mendelejev-systeem, de naam was eka-platina omdat men denkt dat het chemisch analoog is aan dit metaal.
Darmstadtium is een element dat niet alleen kortstondig en onstabiel is, maar ook zeer radioactief, waarbij de meeste isotopen van het atoomverval alfadeeltjes afgeven; dit zijn kale heliumkernen.
Vanwege zijn vluchtige levensduur worden al zijn eigenschappen geschat en kan het nooit voor een bepaald doel worden gebruikt..
Artikel index
- 1 Ontdekking
- 1.1 Duitse verdienste
- 1.2 Synthese
- 2 Structuur van darmstadtium
- 3 Eigenschappen
- 4 toepassingen
- 5 referenties
Ontdekking
Duitse verdienste
Het probleem rond de ontdekking van darmstadtium was dat verschillende teams van onderzoekers zich in opeenvolgende jaren hadden gewijd aan de synthese ervan. Zodra zijn atoom was gevormd, verdween het in bestraalde deeltjes.
Daarom was het niet mogelijk om erachter te komen welke van de teams de eer verdienden dat ze het als eerste hadden gesynthetiseerd, terwijl het zelfs al een uitdaging was om het te detecteren, zo snel te vervallen en radioactieve producten vrij te geven..
Bij de synthese van darmstadtium werkten teams van de volgende onderzoekscentra afzonderlijk: Central Institute for Nuclear Research in Dubná (toen de Sovjet-Unie), Lawrence Berkeley National Laboratory (Verenigde Staten) en Heavy Ion Research Center (in het Duits afgekort als GSI).
De GSI is gevestigd in de Duitse stad Darmstadt, waar ze in november 1994 de radioactieve isotoop synthetiseerden 269Ds. De andere teams hebben andere isotopen gesynthetiseerd: 267Ds in het ICIN, en 273Ds in de LNLB; hun resultaten waren echter niet doorslaggevend in de kritische ogen van de IUPAC.
Elk team had een bepaalde naam voor dit nieuwe element voorgesteld: hahnio (ICIN) en becquerel (LNLB). Maar na een IUPAC-rapport in 2001 had het Duitse GSI-team het recht om het element darmstadtium te noemen..
Synthese
Darmstadtium is het product van de versmelting van metaalatomen. Welke? In principe een relatief zware die als doel of objectief dient, en een andere lichte die in een vacuüm met de eerste zal botsen met een snelheid gelijk aan een tiende van de lichtsnelheid; anders konden de afstotingen tussen de twee kernen niet worden overwonnen.
Zodra de twee kernen efficiënt botsen, zal een kernfusiereactie plaatsvinden. De protonen tellen op, maar het lot van de neutronen is anders. De GSI ontwikkelde bijvoorbeeld de volgende kernreactie, waarvan het eerste atoom werd geproduceerd 269Ds:
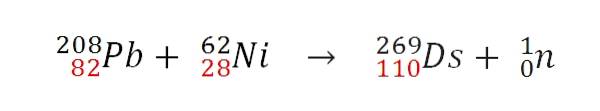
Merk op dat de protonen (in rood) optellen. Door de atoommassa's van de botsende atomen te variëren, worden verschillende isotopen van darmstadtium verkregen. In feite voerde de GSI experimenten uit met de isotoop 64Niet in de plaats van 62Ni, waarvan slechts 9 atomen van de isotoop werden gesynthetiseerd 271Ds.
De GSI slaagde erin om er 3 atomen van te maken 269Ds, maar na een week lang drie biljoen bombardementen per seconde te hebben uitgevoerd. Deze gegevens bieden een overweldigend perspectief op de afmetingen van dergelijke experimenten..
Structuur van darmstadtium
Omdat er maar één darmstadtiumatoom per week kan worden gesynthetiseerd of aangemaakt, is het onwaarschijnlijk dat er genoeg zullen zijn om een kristal te vormen; om nog maar te zwijgen van het feit dat de meest stabiele isotoop is 281Gd, wiens t1/2 het duurt slechts 12,7 seconden.
Daarom zijn onderzoekers, om de kristallijne structuur te bepalen, gebaseerd op berekeningen en schattingen die dichter bij het meest realistische beeld proberen te komen. Aldus wordt geschat dat de structuur van darmstadtium lichaamsgecentreerd kubisch (bcc) is; in tegenstelling tot hun lichtere soortgenoten nikkel, palladium en platina, met vlakgecentreerde kubische (fcc) structuren.
In theorie moeten de buitenste elektronen van de 6d- en 7s-orbitalen deelnemen aan hun metalen binding, volgens hun eveneens geschatte elektronische configuratie:
[Rn] 5f146d87stwee
Experimenteel is echter weinig bekend over de fysische eigenschappen van dit metaal..
Eigendommen

De andere eigenschappen van darmstadtium worden ook geschat, om dezelfde redenen die worden genoemd voor de structuur. Sommige van deze schattingen zijn echter interessant. Darmstadtium zou bijvoorbeeld een nog nobeler metaal zijn dan goud, en ook veel dichter (34,8 g / cm3) dan osmium (22,59 g / cm3) en kwik (13,6 g / cm3.
Met betrekking tot de mogelijke oxidatietoestanden, wordt geschat dat deze +6 (Ds6+), +4 (Ds4+) en +2 (Dstwee+), gelijk aan die van hun lichtere soortgenoten. Daarom, als de atomen van 281Ds voordat ze uiteenvallen, zouden verbindingen zoals DsF worden verkregen6 of DsCl4.
Verrassend genoeg is er een kans om deze verbindingen te synthetiseren, omdat 12,7 seconden de t1/2 van 281Gd, dit is meer dan genoeg tijd om de reacties uit te voeren. Het nadeel blijft echter dat slechts één Ds-atoom per week onvoldoende is om alle gegevens te verzamelen die nodig zijn voor statistische analyse..
Toepassingen
Nogmaals, omdat het zo'n zeldzaam metaal is, momenteel gesynthetiseerd in atomaire en niet-enorme hoeveelheden, is er geen gebruik voor gereserveerd; zelfs niet in de verre toekomst.
Tenzij er een methode wordt uitgevonden om hun radioactieve isotopen te stabiliseren, zullen darmstadtium-atomen alleen maar dienen om wetenschappelijke nieuwsgierigheid op te wekken, vooral wat betreft kernfysica en scheikunde..
Maar als je een manier bedenkt om ze in grote hoeveelheden te maken, zal er meer licht worden geworpen op de chemie van dit ultrazware en kortstondige element..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2020). Darmstadtium. Hersteld van: en.wikipedia.org
- Steve Gagnon. (s.f.). Het Element Darmstadtium. Jefferson Lab-bronnen. Hersteld van: education.jlab.org
- Nationaal centrum voor informatie over biotechnologie. (2020). Darmstadtium. PubChem-database. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (15 december 2019). Darmstadtium. Chemie in zijn elementen. Hersteld van: chemistryworld.com



Niemand heeft nog op dit artikel gereageerd.