
Elektrolyse van water procedure, technieken, waar het voor is
De elektrolyse van water Het is de ontbinding van water in zijn elementaire componenten door het aanleggen van een elektrische stroom. Bij het doorgaan, waterstof en moleculaire zuurstof, H.twee metwee. Deze twee oppervlakken zijn beter bekend onder de naam elektroden..
Theoretisch is het volume van Htwee gevormd moet tweemaal het volume van O zijntwee. Waarom? Omdat het watermolecuul een H / O-verhouding heeft die gelijk is aan 2, dat wil zeggen twee H voor elke zuurstof. Dit verband wordt rechtstreeks geverifieerd met de chemische formule, HtweeO. Er zijn echter veel experimentele factoren die de verkregen volumes beïnvloeden.

Als de elektrolyse wordt uitgevoerd in buizen die zijn ondergedompeld in water (bovenste afbeelding), komt de onderste waterkolom overeen met waterstof, aangezien er een grotere hoeveelheid gas op het oppervlak van de vloeistof druk uitoefent. De bellen omringen de elektroden en stijgen op nadat ze de dampdruk van het water hebben overwonnen.
Merk op dat de buizen zo van elkaar zijn gescheiden dat er een lage gasmigratie van de ene elektrode naar de andere is. Op lage schaal is dit geen direct risico; maar op industriële schaal is het gasvormige mengsel van Htwee metwee het is zeer gevaarlijk en explosief.
Om deze reden zijn de elektrochemische cellen waarin de elektrolyse van water wordt uitgevoerd, erg duur; Ze hebben een ontwerp en elementen nodig die ervoor zorgen dat gassen nooit mengen, een kosteneffectieve stroomvoorziening, hoge concentraties elektrolyten, speciale elektroden (elektrokatalysatoren) en mechanismen om Htwee geproduceerd.
Elektrokatalysatoren vertegenwoordigen wrijving en tegelijkertijd vleugels voor de winstgevendheid van elektrolyse van water. Sommige bestaan uit edelmetaaloxiden, zoals platina en iridium, waarvan de prijzen erg hoog zijn. Vooral op dit punt bundelen onderzoekers hun krachten om efficiënte, stabiele en goedkope elektroden te ontwerpen..
De reden voor deze inspanningen is om de vorming van O te versnellentwee, die optreedt bij lagere snelheden in vergelijking met Htwee. Dit wordt vertraagd door de elektrode waar de O wordt gevormdtwee het brengt als algemeen gevolg de toepassing van een potentieel dat veel groter is dan nodig (overpotentieel); wat is hetzelfde, tot een lagere prestatie en hogere kosten.
Artikel index
- 1 Elektrolysereactie
- 1.1 Halfcelreacties
- 2 Werkwijze
- 3 technieken
- 3.1 Elektrolyse met basisch water
- 3.2 Elektrolyse met polymeer elektrolytisch membraan
- 3.3 Elektrolyse met vaste oxiden
- 4 Waar is de elektrolyse van water voor??
- 4.1 Waterstofproductie en het gebruik ervan
- 4.2 Als een foutopsporingsmethode
- 4.3 Als zuurstoftoevoer
- 5 Huis experiment
- 5.1 Home-variabelen
- 6 referenties
Elektrolysereactie
Bij de elektrolyse van water komen veel complexe aspecten kijken. In algemene termen berust de basis echter op een eenvoudige algemene reactie:
2HtweeO (l) => 2Htwee(g) + Otwee(g)
Zoals uit de vergelijking blijkt, zijn er twee watermoleculen bij betrokken: de ene moet normaal worden gereduceerd of elektronen krijgen, terwijl de andere elektronen moet oxideren of verliezen..
De Htwee Het is een product van de reductie van water, aangezien de toename van elektronen dat de H-protonen bevordert+ kan covalent binden, en de zuurstof wordt omgezet in OH-. Daarom is de H.twee vindt plaats bij de kathode, de elektrode waar reductie optreedt.
Terwijl de Otwee komt van de oxidatie van water, waardoor het de elektronen verliest die het aan waterstof binden, en bijgevolg protonen H vrijgeeft+. De Otwee het wordt geproduceerd bij de anode, de elektrode waar oxidatie optreedt; en in tegenstelling tot de andere elektrode is de pH rond de anode zuur en niet basisch.
Halfcelreacties
Dit kan worden samengevat met de volgende chemische vergelijkingen voor halfcelreacties:
2HtweeO + 2e- => Htwee + 2OH- (Kathode, basis)
2HtweeO => Otwee + 4H+ + 4e- (Anode, zuur)
Water kan echter geen elektronen meer verliezen (4e-) waarvan het andere watermolecuul wint aan de kathode (2e-daarom moet de eerste vergelijking worden vermenigvuldigd met 2 en vervolgens worden afgetrokken met de tweede vergelijking om de netto-vergelijking te verkrijgen:
2 (2HtweeO + 2e- => Htwee + 2OH-
2HtweeO => Otwee + 4H+ + 4e-
6HtweeO => 2Htwee + OFtwee + 4H+ + 4OH-
Maar 4H+ en 40H- vorm 4HtweeOf, dus deze verwijderen vier van de zes moleculen van HtweeOf twee verlaten; en het resultaat is de globale reactie die zojuist is opgewekt.
Halfcelreacties veranderen met pH-waarden, technieken en hebben ook bijbehorende reductie- of oxidatiepotentialen, die bepalen hoeveel stroom er moet worden geleverd om de elektrolyse van water spontaan te laten verlopen..
Werkwijze
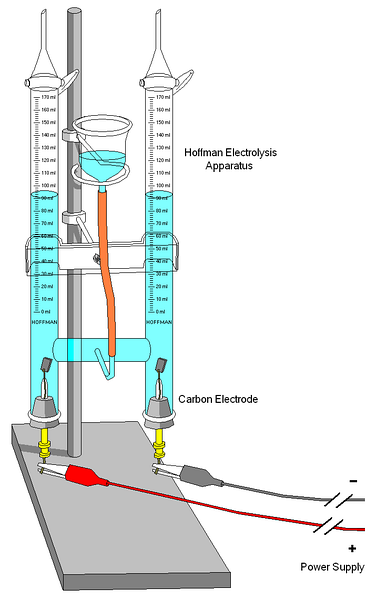
Een Hoffman voltameter wordt getoond in de bovenstaande afbeelding. De cilinders worden gevuld met water en de geselecteerde elektrolyten via het middelste mondstuk. De rol van deze elektrolyten is om de geleidbaarheid van het water te verhogen, omdat er onder normale omstandigheden zeer weinig H-ionen zijn3OF+ en OH- producten van zijn zelfionisatie.
De twee elektroden zijn meestal van platina, hoewel ze in de afbeelding zijn vervangen door koolstofelektroden. Beiden zijn aangesloten op een accu, waarmee een potentiaalverschil (ΔV) wordt toegepast dat de oxidatie van water bevordert (vorming van Otwee.
De elektronen reizen het hele circuit totdat ze de andere elektrode bereiken, waar het water ze wint en H wordttwee en OH-. Op dit punt zijn de anode en kathode al gedefinieerd, wat kan worden onderscheiden door de hoogte van de waterkolommen; degene met de laagste hoogte komt overeen met de kathode, waar de H wordt gevormdtwee.
Aan de bovenkant van de cilinders bevinden zich sleutels waarmee de gegenereerde gassen kunnen worden vrijgegeven. De aanwezigheid van H kan zorgvuldig worden gecontroleerdtwee het laten reageren met een vlam, waarvan de verbranding gasvormig water produceert.
Technieken
Waterelektrolysetechnieken variëren afhankelijk van de hoeveelheid Htwee metwee dat wordt voorgesteld om te genereren. Beide gassen zijn erg gevaarlijk als ze met elkaar worden gemengd, daarom hebben elektrolytische cellen complexe ontwerpen om de toename van de gasdruk en hun diffusie door het waterige medium te minimaliseren..
Evenzo variëren de technieken afhankelijk van de cel, de elektrolyt die aan het water wordt toegevoegd en de elektroden zelf. Aan de andere kant impliceren sommige dat de reactie wordt uitgevoerd bij hogere temperaturen, waardoor het elektriciteitsverbruik wordt verminderd, en andere gebruiken enorme druk om de H te handhaventwee opgeslagen.
Van alle technieken kunnen de volgende drie worden genoemd:
Elektrolyse met alkalisch water
Elektrolyse wordt uitgevoerd met basische oplossingen van de alkalimetalen (KOH of NaOH). Bij deze techniek treden de reacties op:
4HtweeO (l) + 4e- => 2Htwee(g) + 4OH-(ac)
4OH-(ac) => Otwee(g) + 2HtweeO (l) + 4e-
Zoals te zien is, heeft water zowel aan de kathode als aan de anode een basische pH; en verder, de OH- migreren naar de anode waar ze oxideren tot Otwee.
Elektrolyse met polymeer elektrolytisch membraan
Deze techniek maakt gebruik van een vast polymeer dat dient als een permeabel membraan voor H.+, maar ongevoelig voor gassen. Dit zorgt voor meer veiligheid tijdens elektrolyse..
De halfcelreacties voor dit geval zijn:
4H+(ac) + 4e- => 2Htwee(g)
2HtweeO (l) => Otwee(g) + 4H+(ac) + 4e-
H ionen+ migreren van de anode naar de kathode, waar ze worden gereduceerd tot Htwee.
Elektrolyse met vaste oxiden
Heel anders dan andere technieken, deze gebruikt oxiden als elektrolyten, die bij hoge temperaturen (600-900ºC) functioneren als een transportmiddel voor het anion Otwee-.
De reacties zijn:
2HtweeO (g) + 4e- => 2Htwee(g) + 2Otwee-
2Otwee- => Otwee(g) + 4e-
Merk op dat het deze keer de oxide-anionen zijn, Otwee-, degenen die naar de anode reizen.
Waar is de elektrolyse van water voor?
De elektrolyse van water produceert H.twee (g) en Otwee (g). Ongeveer 5% van het waterstofgas dat in de wereld wordt geproduceerd, wordt gemaakt door elektrolyse van water.
De Htwee het is een bijproduct van de elektrolyse van waterige NaCl-oplossingen. De aanwezigheid van zout vergemakkelijkt elektrolyse door de elektrische geleidbaarheid van het water te vergroten.
De algemene reactie die plaatsvindt is:
2NaCl + 2HtweeO => Cltwee + H.twee + 2NaOH
Om het enorme belang van deze reactie te begrijpen, zullen enkele toepassingen van gasvormige producten worden genoemd; Omdat dit uiteindelijk degenen zijn die de ontwikkeling van nieuwe methoden stimuleren om de elektrolyse van water op een efficiëntere en groenere manier te bereiken.
Van allemaal is het meest gewenst om te functioneren als cellen die energetisch het gebruik van verbrandende fossiele brandstoffen vervangen..
Waterstofproductie en het gebruik ervan
-Waterstof die wordt geproduceerd bij elektrolyse kan worden gebruikt in de chemische industrie bij verslavingsreacties, bij hydrogeneringsprocessen of als reductiemiddel bij reductieprocessen.
-Evenzo is het essentieel bij sommige acties van commercieel belang, zoals: de productie van zoutzuur, waterstofperoxide, hydroxylamines, enz. Het is betrokken bij de synthese van ammoniak door een katalytische reactie met stikstof.
-In combinatie met zuurstof produceert het vlammen met een hoog caloriegehalte, met temperaturen tussen 3.000 en 3.500 K. Deze temperaturen kunnen worden gebruikt voor snijden en lassen in de metaalindustrie, voor groei van synthetische kristallen, productie van kwarts, enz..
-Waterbehandeling: een te hoog nitraatgehalte in water kan worden verminderd door het te verwijderen in bioreactoren, waarin bacteriën waterstof gebruiken als energiebron
-Waterstof is betrokken bij de synthese van kunststoffen, polyester en nylon. Bovendien maakt het deel uit van de productie van glas, waardoor de verbranding tijdens het bakken toeneemt..
-Reageert met de oxiden en chloride van vele metalen, waaronder: zilver, koper, lood, bismut en kwik om zuivere metalen te produceren.
-En bovendien wordt het gebruikt als brandstof bij chromatografische analyse met een vlamdetector..
Als een foutopsporingsmethode
De elektrolyse van natriumchloride-oplossingen wordt gebruikt om zwembadwater te zuiveren. Bij elektrolyse wordt aan de kathode waterstof geproduceerd en chloor (Cltwee) bij de anode. Elektrolyse wordt in dit geval een zoutchlorinator genoemd.
Chloor lost op in water om hypochloorzuur en natriumhypochloriet te vormen. Hypochloorzuur en natriumhypochloriet steriliseren water.
Als zuurstoftoevoer
De elektrolyse van water wordt ook gebruikt om zuurstof te genereren op het internationale ruimtestation ISS, dat dient om een atmosfeer van zuurstof in het station te behouden..
Waterstof kan worden gebruikt in een brandstofcel, een methode om energie op te slaan, en het water dat in de cel wordt gegenereerd, kan worden gebruikt voor consumptie door astronauten.
Huis experiment
Waterelektrolyse-experimenten zijn uitgevoerd op laboratoriumschaal met Hoffman voltmeters, of een andere assemblage die het mogelijk maakt om alle noodzakelijke elementen van een elektrochemische cel te bevatten..
Van alle mogelijke samenstellingen en apparatuur is de eenvoudigste een grote doorzichtige watercontainer, die als cel zal dienen. Daarnaast moet elk metalen of elektrisch geleidend oppervlak aanwezig zijn om als elektroden te kunnen functioneren; één voor de kathode en de andere voor de anode.
Voor dit doel kunnen zelfs potloden met scherpe grafietpunten aan beide uiteinden nuttig zijn. En tot slot, een kleine batterij en enkele kabels die deze verbinden met de geïmproviseerde elektroden..
Als het niet wordt uitgevoerd in een doorzichtige houder, wordt de vorming van gasvormige bellen niet op prijs gesteld..
Home variabelen
Hoewel de elektrolyse van water een onderwerp is dat veel intrigerende en hoopvolle aspecten bevat voor wie op zoek is naar alternatieve energiebronnen, kan het huisterexperiment saai zijn voor kinderen en andere omstanders..
Daarom kan voldoende spanning worden aangelegd om de vorming van H te genererentwee metwee het afwisselen van bepaalde variabelen en het opmerken van de veranderingen.
De eerste hiervan is de variatie van de pH van het water, waarbij azijn wordt gebruikt om het water aan te zuren, of NatweeCO3 om het enigszins te baseren. Er moet een verandering optreden in het aantal waargenomen bellen.
Bovendien zou hetzelfde experiment kunnen worden herhaald met warm en koud water. Op deze manier zou dan het effect van temperatuur op de reactie in aanmerking worden genomen..
Om de gegevensverzameling ten slotte iets minder kleurloos te maken, kan een zeer verdunde oplossing van paars koolsap worden gebruikt. Dit sap is een zuur-base-indicator van natuurlijke oorsprong.
Door het toe te voegen aan de container met de geplaatste elektroden, zal worden opgemerkt dat bij de anode het water roze (zuur) zal worden, terwijl bij de kathode de kleur geel zal zijn (basisch).
Referenties
- Wikipedia. (2018). Elektrolyse van water. Hersteld van: en.wikipedia.org
- Chaplin M. (16 november 2018). Elektrolyse van water. Waterstructuur en wetenschap. Hersteld van: 1.lsbu.ac.uk
- Energie-efficiëntie en hernieuwbare energie. (s.f.). Waterstofproductie: elektrolyse. Hersteld van: energy.gov
- Phys.org. (14 februari 2018). Zeer efficiënte, goedkope katalysator voor waterelektrolyse. Hersteld van: phys.org
- Chemie LibreTexts. (18 juni 2015). Elektrolyse van water. Hersteld van: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. en S. Lewis N. (2016). Principes en implementaties van elektrolysesystemen voor watersplitsing. De Royal Society of Chemistry.
- Regenten van de Universiteit van Minnesota. (2018). Elektrolyse van water 2. Universiteit van Minnesota. Hersteld van: chem.umn.edu

Niemand heeft nog op dit artikel gereageerd.