
Oxidatieve fosforyleringsstadia, functies en remmers
De oxidatieve fosforylering is een proces waarbij ATP-moleculen worden gesynthetiseerd uit ADP en Pik (anorganisch fosfaat). Dit mechanisme wordt uitgevoerd door bacteriën en eukaryote cellen. In eukaryote cellen vindt fosforylering plaats in de mitochondriale matrix van niet-fotosynthetische cellen.
ATP-productie wordt aangedreven door de overdracht van elektronen van de co-enzymen NADH of FADHtwee naar de Otwee. Dit proces vertegenwoordigt de hoogste energieproductie in de cel en is afgeleid van de afbraak van koolhydraten en vetten..
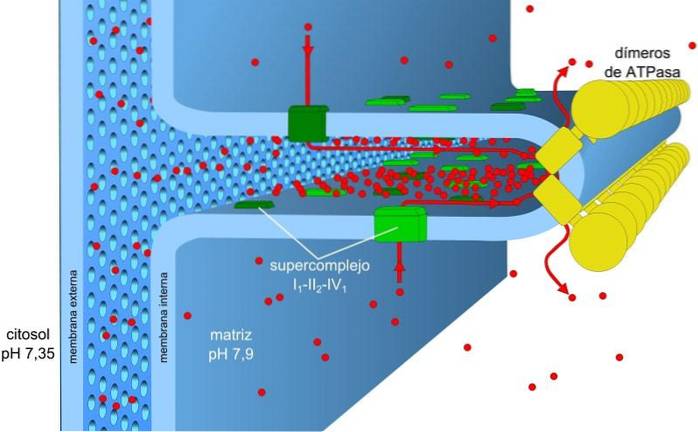
De energie die is opgeslagen in de ladings- en pH-gradiënten, ook wel bekend als de proton-aandrijfkracht, zorgt ervoor dat dit proces kan plaatsvinden. De protongradiënt die wordt gegenereerd, zorgt ervoor dat het buitenste deel van het membraan een positieve lading heeft vanwege de concentratie van protonen (H+) en de mitochondriale matrix is negatief.
Artikel index
- 1 Waar vindt oxidatieve fosforylering plaats?
- 1.1 Celcentrale
- 2 fasen
- 2.1 Elektronentransportketen
- 2.2 Succinaat CoQ-reductase
- 2.3 Koppeling of energietransductie
- 2.4 Chemosmotische koppeling
- 2.5 ATP-synthese
- 3 producten
- 4 functies
- 5 Controle van oxidatieve fosforylering
- 5.1 Gecoördineerde controle van ATP-productie
- 5.2 Controle door acceptant
- 5.3 Ontkoppelingsmiddelen
- 5.4 Remmers
- 6 referenties
Waar vindt oxidatieve fosforylering plaats?
De processen van elektronentransport en oxidatieve fosforylering zijn geassocieerd met een membraan. Bij prokaryoten worden deze mechanismen uitgevoerd via het plasmamembraan. In eukaryote cellen associëren ze zich met het mitochondriale membraan.
Het aantal mitochondriën dat in cellen wordt aangetroffen, varieert afhankelijk van het type cel. Bij zoogdieren hebben erytrocyten bijvoorbeeld geen organellen, terwijl andere celtypen, zoals spiercellen, er wel miljoenen kunnen hebben..
Het mitochondriale membraan bestaat uit een eenvoudig buitenmembraan, een wat complexer binnenmembraan en daartussen de intermembraanruimte, waar veel ATP-afhankelijke enzymen zijn gelokaliseerd..
Het buitenmembraan bevat een eiwit genaamd porine dat de kanalen vormt voor de eenvoudige diffusie van kleine moleculen. Dit membraan is verantwoordelijk voor het behoud van de structuur en vorm van de mitochondriën.
Het binnenmembraan heeft een hogere dichtheid en is rijk aan eiwitten. Het is ook ondoordringbaar voor moleculen en ionen, dus om er doorheen te gaan, hebben ze intermembraaneiwitten nodig om ze te transporteren..
Binnen in de matrix strekken vouwen van het binnenmembraan zich uit, waardoor ribbels worden gevormd waardoor het een groot gebied in een klein volume kan hebben.
Cel-energiecentrale
Het mitochondrion wordt beschouwd als de centrale producent van cellulaire energie. Het bevat de enzymen die betrokken zijn bij de processen van de citroenzuurcyclus, vetzuuroxidatie en redox-enzymen en eiwitten voor elektronentransport en ADP-fosforylering.
De protonenconcentratiegradiënt (pH-gradiënt) en de ladingsgradiënt of elektrisch potentieel in het binnenmembraan van de mitochondriën zijn verantwoordelijk voor de proton-drijfkracht. De lage permeabiliteit van het binnenmembraan voor ionen (anders dan H.+) zorgt ervoor dat de mitochondriën een stabiele spanningsgradiënt hebben.
Elektronisch transport, het pompen van protonen en het verkrijgen van ATP vinden gelijktijdig plaats in de mitochondriën, dankzij de proton-aandrijfkracht. De pH-gradiënt handhaaft zure omstandigheden in het intermembraan en de mitochondriale matrix met alkalische omstandigheden.
Voor elke twee elektronen die naar O worden overgebrachttwee ongeveer 10 protonen worden door het membraan gepompt, waardoor een elektrochemische gradiënt ontstaat. De energie die daarbij vrijkomt, wordt geleidelijk geproduceerd door de doorgang van elektronen door de transportketen.
Stadia
De energie die vrijkomt tijdens de oxidatiereductiereacties van NADH en FADHtwee is aanzienlijk hoog (ongeveer 53 kcal / mol voor elk paar elektronen), dus om te worden gebruikt bij de vervaardiging van ATP-moleculen, moet het geleidelijk worden geproduceerd met de passage van elektronen door transporteurs.
Deze zijn georganiseerd in vier complexen die zich op het binnenste mitochondriale membraan bevinden. De koppeling van deze reacties aan de synthese van ATP wordt uitgevoerd in een vijfde complex.
Elektronentransportketen
NADH draagt een paar elektronen over die complex I van de elektronentransportketen binnengaan. Elektronen worden overgebracht naar het flavine-mononucleotide en vervolgens naar ubiquinon (co-enzym Q) via een ijzer-zwaveltransporteur. Bij dit proces komt een grote hoeveelheid energie vrij (16,6 kcal / mol).
Ubiquinone transporteert elektronen door het membraan naar complex III. In dit complex passeren de elektronen cytochromen b en c1 dankzij een ijzer-zwavel transporteur.
Elektronen gaan van complex III naar complex IV (cytochroom c oxidase), één voor één overgedragen in cytochroom c (perifere membraaneiwit). In complex IV passeren de elektronen een paar koperionen (Cunaartwee+), gevolgd door cytochroom cnaar, dan naar een ander paar koperionen (Cubtwee+) en van hieruit naar cytochroom a3.
Ten slotte worden de elektronen overgebracht naar Otwee dat is de laatste acceptor en vormt een watermolecuul (H.tweeO) voor elk ontvangen elektronenpaar. De doorgang van elektronen van complex IV naar Otwee Het genereert ook een grote hoeveelheid gratis energie (25,8 kcal / mol).
Succinaat CoQ-reductase
Complex II (succinaat CoQ-reductase) ontvangt een paar elektronen uit de citroenzuurcyclus, door de oxidatie van een succinaatmolecuul tot fumaraat. Deze elektronen worden overgebracht naar de FAD en gaan vervolgens door een ijzer-zwavelgroep naar ubiquinon. Van dit co-enzym gaan ze over naar complex III en volgen de eerder beschreven route.
De energie die vrijkomt bij de elektronenoverdrachtsreactie op de FAD is niet voldoende om de protonen door het membraan te drijven, dus er wordt geen proton-aandrijfkracht gegenereerd in deze stap van de ketting, en bijgevolg levert de FADH minder H op.+ dat de NADH.
Koppeling of transductie van energie
De energie die wordt gegenereerd in het eerder beschreven elektronentransportproces moet kunnen worden gebruikt voor de productie van ATP, een reactie die wordt gekatalyseerd door het enzym ATP-synthase of complex V. Het behoud van deze energie staat bekend als energiekoppeling, en het mechanisme is moeilijk te karakteriseren.
Er zijn verschillende hypothesen beschreven om deze energietransductie te beschrijven. De meest geaccepteerde is de chemiosmotische koppelingshypothese, die hieronder wordt beschreven..
Chemosmotische koppeling
Dit mechanisme stelt voor dat de energie die wordt gebruikt voor ATP-synthese afkomstig is van een protongradiënt in celmembranen. Dit proces grijpt in in de mitochondriën, chloroplasten en bacteriën en is gekoppeld aan het transport van elektronen.
Complexen I en IV van elektronentransport fungeren als protonenpompen. Deze ondergaan conformationele veranderingen waardoor ze protonen in de intermembrane ruimte kunnen pompen. In complex IV worden voor elk elektronenpaar twee protonen uit het membraan gepompt en blijven er nog twee in de matrix, die H vormen.tweeOF.
Ubiquinon in complex III accepteert protonen van complexen I en II en geeft ze af aan de buitenkant van het membraan. Complexen I en III laten elk de doorgang van vier protonen toe voor elk paar getransporteerde elektronen.
De mitochondriale matrix heeft een lage concentratie protonen en een negatief elektrisch potentieel, terwijl de intermembrane ruimte de omgekeerde condities vertoont. De stroom van protonen door dit membraan vertegenwoordigt de elektrochemische gradiënt die de nodige energie opslaat (± 5 kcal / mol per proton) voor de synthese van ATP..
ATP-synthese
Het enzym ATP-synthetase is het vijfde complex dat betrokken is bij oxidatieve fosforylering. Het is verantwoordelijk voor het benutten van de energie van de elektrochemische gradiënt om ATP te vormen.
Dit transmembraaneiwit bestaat uit twee componenten: F.0 en F1. Onderdeel F0 maakt de terugkeer van protonen mogelijk naar de mitochondriale matrix die als een kanaal functioneert en de F1 katalyseert de synthese van ATP door ADP en P.ik, gebruikmakend van de energie van genoemde terugkeer.
Het ATP-syntheseproces vereist een structurele verandering in F1 en de montage van componenten F0 en F1. Proton-translocatie door F0 veroorzaakt conformationele veranderingen in drie subeenheden van F1, waardoor het als een rotatiemotor kan werken en de vorming van ATP kan sturen.
De subeenheid die verantwoordelijk is voor de binding van ADP met Pik het gaat van een zwakke toestand (L) naar een actieve toestand (T). Wanneer ATP wordt gevormd, gaat een tweede subeenheid in een open toestand (O) die de afgifte van dit molecuul mogelijk maakt. Nadat ATP is vrijgegeven, gaat deze subeenheid van de open toestand naar een inactieve toestand (L).
ADP- en P-moleculenik binden aan een subeenheid die is overgegaan van een O-status naar een L-status.
Producten
De elektronentransportketen en fosforylering produceren ATP-moleculen. De oxidatie van NADH levert ongeveer 52,12 kcal / mol (218 kJ / mol) vrije energie op.
De algemene reactie voor de oxidatie van NADH is:
NADH + 1⁄2 Otwee +H.+ ↔ H.tweeO + NAD+
Overdracht van elektronen van NADH en FADHtwee vindt plaats via verschillende complexen, waardoor de vrije energieverandering ΔG ° kan worden verdeeld in kleinere energiepakketten, die zijn gekoppeld aan ATP-synthese.
De oxidatie van één molecuul NADH genereert de synthese van drie moleculen ATP. Terwijl de oxidatie van een FADH-molecuultwee koppelt aan de synthese van twee ATP's.
Deze co-enzymen zijn afkomstig van de glycolyse- en citroenzuurcyclusprocessen. Voor elk molecuul afgebroken glucose produceren ze uiteindelijk 36 of 38 moleculen ATP, afhankelijk van de locatie van de cellen. 36 ATP wordt geproduceerd in de hersenen en skeletspieren, terwijl 38 ATP wordt geproduceerd in spierweefsel..
Kenmerken
Alle organismen, eencellig en meercellig, hebben minimale energie in hun cellen nodig om de processen in hen uit te voeren en op hun beurt vitale functies in het hele organisme te behouden..
Metabole processen hebben energie nodig om plaats te vinden. De meeste bruikbare energie wordt verkregen uit de afbraak van koolhydraten en vetten. Deze energie is afkomstig van het oxidatieve fosforyleringsproces.
Controle van oxidatieve fosforylering
Het ATP-gebruik in cellen regelt de synthese ervan, en op zijn beurt reguleert het, vanwege de koppeling van oxidatieve fosforylering met de elektronentransportketen, in het algemeen ook de snelheid van elektronentransport..
Oxidatieve fosforylering heeft een strikte controle die ervoor zorgt dat ATP niet sneller wordt gegenereerd dan wordt verbruikt. Er zijn bepaalde stappen in het proces van elektronentransport en gekoppelde fosforylering die de snelheid van energieproductie regelen..
Gecoördineerde controle van ATP-productie
De belangrijkste routes voor energieproductie (cellulaire ATP) zijn glycolyse, de citroenzuurcyclus en oxidatieve fosforylering. Gecoördineerde controle van deze drie processen reguleert de ATP-synthese.
De controle van fosforylering door de massa-actieverhouding van ATP hangt af van de precieze bijdrage van elektronen in de transportketen. Dit hangt weer af van de [NADH] / [NAD+] die hoog wordt gehouden door de werking van glycolyse en de citroenzuurcyclus.
Deze gecoördineerde controle wordt uitgevoerd door de glycolysecontrolepunten (PFK geremd door citraat) en de citroenzuurcyclus (pyruvaat dehydrogenase, citraat tapease, isocitraat dehydrogenase en α-ketoglutaraat dehydrogenase) te reguleren..
Controle door acceptor
Complex IV (cytochroom c oxidase) is een enzym dat wordt gereguleerd door een van zijn substraten, dat wil zeggen dat zijn activiteit wordt gecontroleerd door gereduceerd cytochroom c (ctwee+), die op zijn beurt in evenwicht is met de concentratieverhouding tussen [NADH] / [NAD+] en de massa-actieverhouding van [ATP] / [ADP] + [Pik.
Hoe hoger de verhouding [NADH] / [NAD+] en verlaag de [ATP] / [ADP] + [Pik], hoe hoger de concentratie cytochroom [ctwee+] en hoe groter de activiteit van complex IV. Dit wordt bijvoorbeeld geïnterpreteerd als we organismen vergelijken met verschillende activiteiten van rust en hoge activiteit.
Bij een persoon met een hoge fysieke activiteit is het verbruik van ATP en dus de hydrolyse ervan tot ADP + Pik zal erg hoog zijn, waardoor een verschil in de massa-actieverhouding ontstaat dat een toename van [ctwee+] en dus een toename van de ATP-synthese. Bij een persoon in rust doet zich de omgekeerde situatie voor.
Uiteindelijk neemt de snelheid van oxidatieve fosforylering toe met de concentratie van ADP in de mitochondriën. Deze concentratie hangt af van de ADP-ATP-translocatoren die verantwoordelijk zijn voor het transport van adeninenucleotiden en Pik van het cytosol naar de mitochondriale matrix.
Ontkoppelingsmiddelen
Oxidatieve fosforylering wordt beïnvloed door bepaalde chemische agentia, die het elektronentransport mogelijk maken zonder dat ADP-fosforylering optreedt, waardoor energieproductie en -behoud worden ontkoppeld.
Deze middelen stimuleren het zuurstofverbruik van de mitochondriën in afwezigheid van ADP, waardoor ook de ATP-hydrolyse toeneemt. Ze werken door een tussenpersoon te elimineren of een energietoestand van de elektronentransportketen te doorbreken.
2,4-dinitrofenol, een zwak zuur dat door mitochondriale membranen gaat, is verantwoordelijk voor het dissiperen van de protongradiënt, omdat ze zich eraan binden aan de zure kant en ze afgeven aan de basische kant.
Deze verbinding werd gebruikt als een ‘dieetpil’ omdat het een toename van de ademhaling bleek te veroorzaken, dus een toename van de stofwisseling en het daarmee gepaard gaande gewichtsverlies. Er werd echter aangetoond dat het negatieve effect zelfs de dood kan veroorzaken.
De dissipatie van de protongradiënt produceert warmte. Cellen in bruin vetweefsel gebruiken hormonaal gecontroleerde ontkoppeling om warmte te produceren. Hibernerende zoogdieren en pasgeborenen zonder haar bestaan uit dit weefsel dat dient als een soort thermische deken..
Remmers
Verbindingen of remmende middelen voorkomen beide de consumptie van Otwee (elektronentransport) zoals bijbehorende oxidatieve fosforylering. Deze middelen voorkomen de vorming van ATP door gebruik te maken van de energie die wordt geproduceerd bij elektronisch transport. Daarom stopt de transportketen omdat het genoemde energieverbruik niet beschikbaar is..
Het antibioticum oligomycine werkt in veel bacteriën als een fosforyleringsremmer en voorkomt de stimulatie van ADP tot ATP-synthese.
Er zijn ook ionofoormiddelen, die in vet oplosbare complexen vormen met kationen zoals K+ en Na+, en ze passeren het mitochondriale membraan met deze kationen. De mitochondriën gebruiken vervolgens de energie die wordt geproduceerd bij elektronentransport om kationen te pompen in plaats van ATP te synthetiseren..
Referenties
- Alberts, B., Bray, D., Hopkin, K., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. (2004). Essentiële celbiologie. New York: Garland Science.
- Cooper, G. M., Hausman, R. E. & Wright, N. (2010). De cel. (blz. 397-402). Marban.
- Devlin, T. M. (1992). Textbook of biochemistry: with clinical correlations. John Wiley & Sons, Inc..
- Garrett, R. H., en Grisham, C. M. (2008). Biochemie. Thomson Brooks / Cole.
- Lodish, H., Darnell, J. E., Berk, A., Kaiser, C. A., Krieger, M., Scott, M. P., en Matsudaira, P. (2008). Moleculaire celbiologie. Macmillan.
- Nelson, D. L., en Cox, M. M. (2006). Lehninger-principes van biochemie 4e editie. Ed Omega. Barcelona.
- Voet, D., & Voet, J. G. (2006). Biochemie. Panamerican Medical Ed..
Niemand heeft nog op dit artikel gereageerd.