
Kenmerken, typen, technieken en histologie van bloeduitstrijkjes

De Bloedvlek Het is een uitstrijkje van perifeer bloed dat wordt gebruikt om de componenten in de bloedsomloop te analyseren. De observatie van een bloeduitstrijkje levert hematologische gegevens op die erg nuttig zijn voor de diagnose en opvolging van vele pathologieën..
Het bloeduitstrijkje maakt het mogelijk om het aantal verschillende soorten witte bloedcellen (leukocytenformule) te kwantificeren, evenals de analyse van de morfologie en vorm van erytrocyten, leukocyten en bloedplaatjes..

Het kan afwijkingen in het aantal cellen detecteren, zoals: leukocytose of leukopenie, lymfocytose of lymfopenie, neutrofilie of neutropenie, trombocytose of trombocytopenie en eosinofilie. Afwijkingen in celvorm en -grootte kunnen ook worden gezien..
Bovendien is het mogelijk om verschillende soorten anemie, leukemie en bacteriële of bloedparasitaire infecties op te sporen..
Hiervoor zijn er verschillende soorten uitstrijkjes die worden gemaakt, afhankelijk van het doel van het onderzoek. Er zijn dunne uitstrijkjes en dikke uitstrijkjes. Deze uitstrijkjes verschillen in de uitvoeringstechniek en in het doel van het onderzoek..
Degenen met fijne druppels worden gebruikt als hulpmiddel om de hematologie te voltooien. Dit levert gegevens op over de leukocytenformule, naast de analyse van de vorm en morfologie van de drie celreeksen waaruit het bloed bestaat: rode reeks, witte reeks en bloedplaatjes. Hoewel ze ook dienen als aanvulling op de studie van dikke bloedfilm.
Dikke bloedfilm wordt gebruikt voor de diagnose van ziekten veroorzaakt door hemoparasieten, zoals malaria of malaria, toxoplasmose, leishmaniasis, de ziekte van Chagas, babesiose en microfilariasis.
Artikel index
- 1 Kenmerken van een bloeduitstrijkje
- 2 soorten bloeduitstrijkjes
- 3 Technieken voor het afnemen van bloedmonsters
- 4 Technieken voor het maken van het bloeduitstrijkje
- 4.1 -Slides uitstrijkjes
- 4.2 -Rooien op dekglaasjes
- 4.3 - Met geautomatiseerde apparatuur
- 5 Dikke uitstrijktechniek
- 6 Kleuring van uitstrijkjes
- 6.1 Giemsa-kleuring
- 6.2 Wright's vlek
- 7 soorten defecte uitstrijkjes
- 7.1 Uitstrijkjes met gebieden van verschillende diktes (dun en dik afgewisseld)
- 7.2 Uitstrijkjes met zeer korte uitstrijkjes
- 7.3 Smeer met een geharkt gebied tegen het einde van het uitstrijkje
- 7.4 Uitstrijkjes met vorming van vacuolen of heldere ronde of elliptische gebieden
- 7.5 Zeer dikke of zeer dunne uitstrijkjes
- 8 Histologie
- 8.1 -Erytrocyten of rode bloedcellen
- 8.2 -Witte bloedcellen of leukocyten
- 8.3 - Bloedplaatjes
- 9 Pathologische elementen
- 9.1 Bloedparasieten
- 9.2 Bacteriën
- 9.3 Onrijpe cellen
- 10 referenties
Kenmerken van een bloeduitstrijkje
Een goed bloeduitstrijkje moet aan bepaalde kenmerken voldoen. Onder hen kunnen we noemen:
-Het monster moet voldoen aan de minimale kwaliteitseisen om representatief te zijn.
-De bemonstering moet goed worden uitgevoerd.
-Tijdige uitvoering van het uitstrijkje.
-Indien uitgevoerd met veneus bloed, gebruik dan een antistollingsmiddel dat de cellen niet vervormt en meng de buis voordat u het uitstrijkje maakt..
-Als het gedaan is met capillair bloed, gooi de eerste druppel dan weg.
-De spreiding moet homogeen zijn. Dit zorgt ervoor dat de cellen gelijkmatig verdeeld zijn en dat er een goede analyse van de bloedcellen, qua vorm en aantal, gedaan kan worden..
-De zijkanten van het uitstrijkje moeten van begin tot eind glad zijn.
-Het uitstrijkje moet een marge van 1 tot 2 mm aan de zijkanten van het objectglaasje respecteren.
-De smeerlaag moet van het begin tot het einde geleidelijk in dikte afnemen (uitstrijkje met dunne druppel volgens de schuifmethode).
-Moet correct worden geëtiketteerd om verwarring met het monster te voorkomen.
-Fixeer en kleur op de juiste manier voor duidelijke observatie van bloedelementen.
-Laat het uitstrijkje goed drogen voordat u het preparaat onder de microscoop monteert. Door olie-immersie op een nat uitstrijkje te plaatsen, worden micellen gevormd die voorkomen dat de cellen worden gezien..
Soorten bloeduitstrijkjes
Perifere bloeduitstrijkjes kunnen worden ingedeeld in een dun uitstrijkje en een dik uitstrijkje. Degenen met een dunne laag worden gebruikt voor de studie van de leukocytenformule en morfologische observatie van bloedcellen. Je kunt ook extracellulaire bacteriën zien zoals borrelia en intracellulaire hemoparasieten, zoals onder andere plasmodium..
In de fijne klodder kan de soort van de parasiet worden geïdentificeerd, daarom is het een meer specifieke techniek dan de dikke klodder, maar de dikke klodder is gevoeliger, omdat het een concentratietechniek is die wordt gebruikt voor de uitputtende zoektocht naar extracellulaire hemoparasieten..
Er zijn twee soorten uitstrijkjes met fijne druppels: uitstrijkjes op dia's en uitstrijkjes op dekglaasjes. De dikke uitstrijkjes worden op objectglaasjes gemaakt.
Technieken voor het afnemen van bloedmonsters
Bloeduitstrijkjes kunnen worden gemaakt van een capillaire punctie of een veneus monster genomen met antistollingsmiddel. Als het wordt gedaan uit bloed met een antistollingsmiddel, kan het uitstrijkje tot 2 uur na het nemen van het monster worden voorbereid..
Voorzichtigheid is geboden bij het gebruik van anticoagulantia die de bloedcellen niet vervormen. De beste optie is EDTA. Integendeel, het gebruik van anticoagulantia zoals trinatriumcitraat moet worden vermeden..
Als het monster wordt genomen door middel van capillaire punctie, moet het uitstrijkje onmiddellijk worden verlengd, voordat het bloed stolt.
De eerste druppel moet worden weggegooid, zodat de volgende druppel spontaan kan ontsnappen om verdunning van het monster met de weefselvloeistof te voorkomen. Het is de meest aanbevolen techniek voor het observeren van celmorfologie, aangezien het bloed geen toevoegingen bevat.
Voor de waarneming van hemoparasieten concluderen Solari et al. In hun onderzoek dat beide technieken (venapunctie en capillair) even efficiënt zijn..
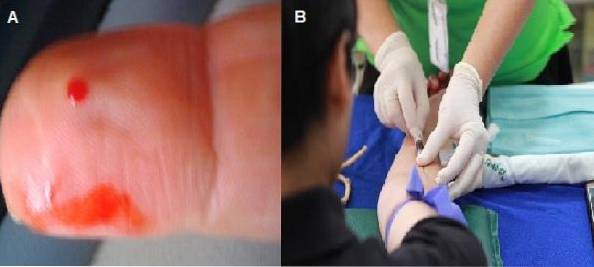
Technieken voor de voorbereiding van het bloeduitstrijkje
Het bloeduitstrijkje kan handmatig worden gemaakt op objectglaasjes of op een dekglaasje of objectglaasje. Het is ook mogelijk door middel van geautomatiseerde apparatuur.
-Smeer op dia's
Vanwege de eenvoudige bediening is dit de techniek die de meeste laboratoria prefereren.
Plaats met een pasteurpipet een niet erg dikke of erg fijne druppel bloed in het midden van een uiteinde van een schoon microscoopglaasje..
Het uitstrijkje wordt gemaakt met behulp van een andere dia met een geslepen uiteinde. De glijbaan van geslepen glas wordt loodrecht op het andere uiteinde van de druppel geplaatst..
Hij helt over in een hoek tussen 30 - 45 ° en glijdt naar de val; Bij aanraking zet het lineair uit over de rand van de grondglijbaan en met een constante en gedefinieerde beweging keert het vel terug; voor het bereiken van het einde wordt de glijbaan opgetild.
Op deze manier wordt een homogene laag over het oppervlak van de opnameschuif verdeeld..
Het uitstrijkje mag drogen. Het wordt vervolgens gefixeerd en gekleurd met de voorkeursbeits. Goed laten drogen voordat u onder de microscoop kijkt. Een druppel olie wordt op het gezicht geplaatst dat het uitstrijkje presenteert en wordt bekeken onder een lichtmicroscoop.
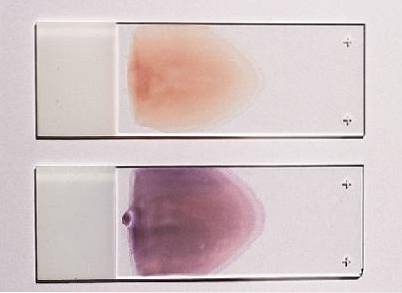
Delen van het uitstrijkje gemaakt op dia's
Bij dit type uitstrijkje kunnen drie gedefinieerde gebieden worden onderscheiden: de kop, het lichaam en de staart. De kop komt overeen met het gebied waar het uitstrijkje begint, het is het dikste gebied en het is niet goed om te observeren.
Het lichaam is het centrale of tussenliggende deel van het uitstrijkje, het is het beste gebied om onder de microscoop te observeren, omdat de cellen daar gelijkmatig verdeeld zijn en hun morfologie behouden blijft.
De staart komt overeen met het laatste deel van het uitstrijkje; hier is de verdeling niet langer uniform en neigt de morfologie van de erytrocyten verloren te gaan.
Kwaliteitscontrole in de schuiftechniek
Bij deze techniek speelt het een fundamentele rol:
-Reiniging en ontvetting van het objectglaasje: zorgt voor een goed objectglaasje van het preparaat.
-De grootte van de druppel: bij zeer grote druppels wordt een dikker en langer uitstrijkje verkregen, bij een zeer kleine druppel wordt de spreiding korter en extreem fijn.
-De snelheid toegepast in de extensie: hoe lager de snelheid waarmee het uitstrijkje dunner zal zijn, hoe hoger de snelheid zal het dikker zijn.
-De uitvoeringshoek: hoe kleiner de hoek, hoe fijner de uitstrijk, hoe hoger de hoek, hoe dikker.
-Smeer op dekglaasje
Het wordt niet algemeen gebruikt omdat het omslachtig is om de kwetsbare dekglaasjes te hanteren, maar het biedt grote voordelen, aangezien een betere verdeling van de cellen door het uitstrijkje wordt verkregen..
Een niet erg dikke of erg fijne druppel wordt in het midden van een dekglaasje geplaatst. Onmiddellijk wordt er een ander dekglaasje bovenop geplaatst, zodanig dat de uiteinden van beide dekglaasjes uitsteken en een ster vormen.
De druppel verspreidt zich spontaan over het oppervlak van beide dekglaasjes. Aan het einde van de verlenging schuift elke lamel snel naar de andere kant van elkaar (de ene naar rechts en de andere naar links).
De techniek levert twee uitstrijkjes op in plaats van één.
Ze worden te drogen gelegd met de uitgespreide kant naar boven. Eenmaal droog, wordt het gefixeerd en gekleurd met de techniek van keuze. Laat het drogen. Een druppel immersie-olie wordt op een objectglaasje geplaatst, het uitstrijkje wordt met het uitstrijkje naar beneden geplaatst en onder een microscoop bekeken..
Kwaliteitscontrole in de dekglaasje techniek
Om bij deze techniek een goed uitstrijkje te krijgen is het belangrijk om:
-Het reinigen van de dekglaasjes (helpt bij het goed glijden van het monster).
-De grootte van de druppel (beïnvloedt de dikte van het uitstrijkje).
-De snelheid waarmee de dekglaasjes worden gescheiden (beïnvloedt de homogeniteit van het uitstrijkje).
-Met geautomatiseerde apparatuur
Ze kunnen worden gedaan met een van deze apparaten: Spinner en Autoslide.
De Spinner bestaat uit het plaatsen van een glaasje met een druppel bloed op een speciale centrifugeplaat. Het monster wordt met hoge snelheid gecentrifugeerd; op deze manier wordt een homogeen en fijn uitstrijkje van het monster gevormd. Nadeel van de mogelijkheid van hemolyse van het monster.
De Autoslide is een instrument dat mechanisch de bewegingen uitvoert voor het uitvoeren van het uitstrijkje op objectglaasjes. U kunt het uitstrijkje ook repareren en beitsen. Het kan zelfs worden aangepast aan sommige automatische hematologietellers.
Dikke uitstrijktechniek
Om hemoparasieten te zoeken, wordt aanbevolen om twee uitstrijkjes uit te voeren: een met een fijne druppel en een met een dikke druppel..
Voer een capillaire punctie uit, maak de eerste druppel schoon. Plaats een fijne druppel op een glaasje en smeer zoals eerder uitgelegd. Plaats voor de dikke kraal een grote kraal op een andere dia en spreid deze uit in een vierkant van 1,55 mm. Laat de twee uitstrijkjes drogen.
Vlekvlekken
Voor degenen met fijne druppels kunnen onder andere Giemsa of Wright-vlekken worden gebruikt. Giemsa of May-Grunwald Giemsa-beits wordt aanbevolen voor dikke uitstrijkjes.
Giemsa-vlek
Het uitstrijkje wordt 3 minuten gefixeerd met methanol, uitgelekt en opnieuw gedroogd. Het uitstrijkje wordt vervolgens gedurende 10-15 minuten bedekt met Giemsa-kleurstof. Het wordt gewassen met gedestilleerd water en gedroogd. Om onder de microscoop te observeren wordt een druppel immersie-olie geplaatst.
Wright's vlek
Het uitstrijkje wordt gedurende 5 minuten bedekt met Wright's vlek. Gooi de bufferoplossing weg en plaats deze gedurende 6 minuten op pH 6,8. Blaas het preparaat om te homogeniseren. Was met gedestilleerd water en laat drogen. Observeer onder de microscoop.
Defecte soorten uitstrijkjes
Komt voor bij cursisten van de fijne druppeltechniek met dia's.
Smeer met gebieden van verschillende diktes (dun en dik afgewisseld)
Het is omdat de uitgevoerde beweging niet constant was tijdens de spreiding, waardoor stops en herstarts werden gemaakt.
Zeer korte uitstrijkje
Ze hebben 2 oorzaken: de ene is te wijten aan het feit dat de grondglijbaan is opgetild voordat hij het andere uiteinde van de glijbaan bereikt. In dit geval is het extreem dik en kort.
Aan de andere kant, als het uitstrijkje kort maar dun is, komt dat doordat de grootte van de druppel erg klein was..
Smeer met een geharkt gebied tegen het einde van het uitstrijkje
Het heeft verschillende oorzaken: een is dat de grondrand defect is, dat de druk die wordt uitgeoefend op de opvangglijbaan toeneemt op het moment van spreiden of dat de grondrand van de glijbaan versleten is.
Smeer met de vorming van vacuolen of heldere ronde of elliptische gebieden
Ze zijn te wijten aan het gebruik van vette uitstrijkjes (slecht gewassen en ontvet).
Zeer dikke of zeer dunne uitstrijkjes
Te grote druppels zullen van begin tot eind zeer dikke uitstrijkjes produceren en zeer kleine druppels zullen zeer fijne uitstrijkjes produceren.
Histologie
Bloedcellen zijn te zien in een bloeduitstrijkje. Onder hen zijn:
-Erytrocyten of rode bloedcellen
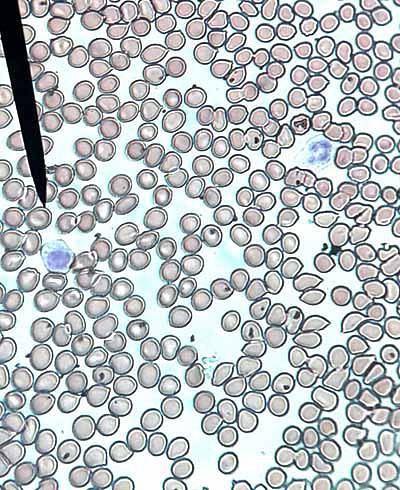
Het aantal erytrocyten of rode bloedcellen is ongeveer 5 x 106 mm3 in man en 4,5 x 106 bij vrouwen. Rode bloedcellen hebben de vorm van biconcave schijven, met een centrale fysiologische bleekheid. Afzonderlijk te zien (normaal) of stapelbaar in rouleaux (abnormaal).
Uitstrijkjes tonen ook poikilocytose (rode bloedcellen in verschillende vormen), anisocytose (rode bloedcellen van verschillende grootte), anisopoikilocytose (verschillende vormen en maten), anisochromie (verschillende kleuren), erytroblasten (onvolgroeide rode bloedcellen), microcytose (kleinere rode bloedcellen)) en macrocyten (grotere erytrocyten).
Wanneer ze een tekort vertonen in de hoeveelheid hemoglobine en de centrale bleekheid toeneemt, wordt er gezegd dat er hypochromie is. Wanneer een normale rode reeks wordt waargenomen, wordt deze gerapporteerd als normocytisch en normochroom..
-Witte bloedcellen of leukocyten
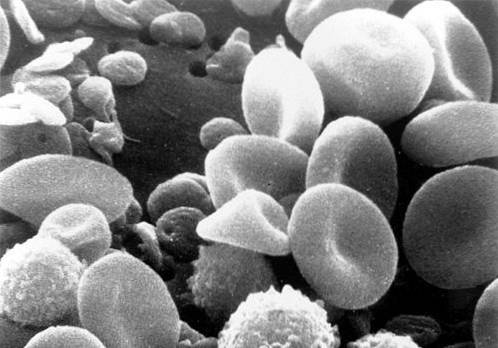
De normale hoeveelheid varieert van 5.000 tot 10.000 mm3. Ze zijn veranderd bij infectieprocessen, bij allergieën en bij leukemie. In het bloeduitstrijkje zijn verschillende typen te onderscheiden, die hieronder worden toegelicht.
Gesegmenteerde neutrofielen
Ze vertegenwoordigen 55-65% van de totale leukocyten. Ze meten tussen 10-15 μm. Ze hebben een gesegmenteerde of gelobde kern die verschillende morfologieën aanneemt, daarom wordt het polymorfonucleair genoemd.
Ze hebben overvloedige neutrofiele korrels in hun cytoplasma en enkele azurofielen. Toename van bacteriële infecties (neutrofilie), afname van virale infecties (neutropenie).
Morfologische afwijkingen zoals pleokaryocytose (hyper-gesegmenteerde kernen), boog (onrijpe cellen) of macropolicieten (ovaalvormig en groot) kunnen worden waargenomen..
Andere wijzigingen:
-Giftige granulaten
-Pseudo Pelger-neutrofielen (kern zijn niet-gelobd of tweelobbig).
-Döhle-lichaampjes: donkerblauwe cytoplasmatische insluitsels.
-Verhoogde cytoplasmatische basofilie.
-Intracytoplasmatische vacuolen.
-Cellulaire pyknose (verlies van internucleaire bruggen).
Gesegmenteerde eosinofielen
Ze vertegenwoordigen 1-3% van de totale witte bloedcellen. Ze meten 9-10 μm. Ze worden gekenmerkt door de aanwezigheid van overvloedige acidofiele cytoplasmatische korrels en enkele azurofielen. De kern heeft twee lobulaties. Hun aantal neemt toe in allergieën en ziekten van parasitaire oorsprong.
Gesegmenteerde basofielen
Ze zijn uiterst zeldzaam en vertegenwoordigen 0-1% van de leukocyten. Ze meten 10-12 μm. De kern is meestal onregelmatig in grenzen en kan dubbellobbig zijn, maar wordt niet waargenomen vanwege het grote aantal basofiele grove granulaties in het cytoplasma. In zeer zeldzame gevallen kan basofilie worden gezien.
Lymfocyten
Het zijn kleine cellen met basofiel cytoplasma, met een goed gedefinieerde, ronde kern, met gecondenseerd chromatine. De kern omvat bijna de hele cel. Ze vertegenwoordigen 26-40% van de bloedleukocyten. Ze verhogen het aantal virale infecties (lymfocytose). Reactieve lymfocyten zijn te zien.
Monocyten
Cellen groter dan lymfocyten, met groter cytoplasma en lossere chromatine ovale kernen. Ze meten 9-12 μm. Het cytoplasma is overvloedig en ziet er gewoonlijk bleek grijsblauw uit met standaardkleuringstechnieken. Onder de veranderingen kunnen gevacuoleerde monocyten en monocytose worden waargenomen..
-Bloedplaatjes
Ze meten tussen 1,5 en 3 μm. De vorm is rond of ovaal. De normale waarde varieert van 150.000 tot 350.000 bloedplaatjes / mm3. Ze kunnen sommige virale infecties verminderen. Ze hebben geen kern en zijn paars gekleurd. Afwijkingen kunnen worden gezien in deze reeks, zoals macro- of microplaatjes, trombocytose of trombocytopenie en plaatjesfragmenten.
Pathologische elementen
Hematische parasieten
Hemoparasieten, zoals de veroorzaker van malaria of malaria (parasieten van het geslacht Plasmodium), kunnen in bloeduitstrijkjes worden gezien. Om deze reden is het belangrijk dat het uitstrijkje handmatig wordt geanalyseerd, aangezien geautomatiseerde apparatuur deze bevinding over het hoofd ziet..
Bacteriën
Bij pathologieën zoals recidiverende koorts of de ziekte van Lyme kan de veroorzaker ervan worden waargenomen. In dit geval komt het overeen met de spirocheten Borrelia recurrenti Maar de Borrelia burgdorferi in het bloeduitstrijkje.
Onrijpe cellen
Ernstige gevallen worden onder andere waargenomen bij leukemieën, leukemoïde reacties en leukoerythroblastische reacties. Bij bacteriële infecties kunnen er lichte afwijkingen naar links zijn (aanwezigheid van boeven). Erythroblasten kunnen ook worden gezien bij sommige anemieën.
Referenties
- Bloed en hematopoëtisch weefsel. Beschikbaar op: sld.cu
- Gomez A, Casas M. 2014. Angel. Klinische interpretatie van het laboratorium. 8e editie. Panamerican Medical Editorial.
- Solari Soto L, Soto Tarazona A, Mendoza Requena D, Llanos Accounts A. Vergelijking van parasitaire dichtheden in dikke veneuze bloeddruppels versus acupressuur bij de diagnose van Malaria vivax. Rev Med Hered 2002; 13 (4): 140-143. Beschikbaar op: scielo.org.
- Terry Leonard Nelson, Mendoza Hernández Carlos. Belang van de studie van het perifere bloeduitstrijkje bij ouderen. Medisur 2017; 15 (3): 362-382. Beschikbaar op: scielo.sld
- Grinspan S. De studie van het perifere bloeduitstrijkje. Voortgezette medische opleiding. Verkrijgbaar bij: bvs.hn/RMH



Niemand heeft nog op dit artikel gereageerd.