
Heptaan (C7H16) structuur, eigenschappen en toepassingen
De heptaan is een organische verbinding waarvan de chemische formule C is7H.16 en omvat negen structurele isomeren, waarvan de bekendste lineair is. Het is een koolwaterstof, met name een alkaan of paraffine, die in de meeste organische chemielaboratoria wordt aangetroffen, of het nu gaat om onderwijs of onderzoek..
In tegenstelling tot andere paraffinische oplosmiddelen heeft heptaan een lagere vluchtigheid, waardoor het relatief veiliger te gebruiken is; op voorwaarde dat er geen warmtebron rond uw dampen is en u in een afzuigkap werkt. Afgezien van zijn ontvlambaarheid, is het een verbinding die inert genoeg is om als medium voor organische reacties te dienen..
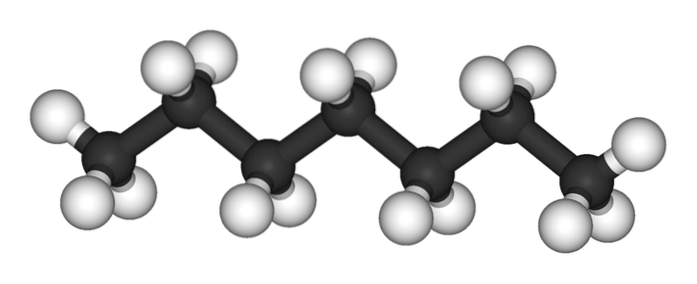
De bovenste afbeelding toont de structuur van het n-heptaan, het lineaire isomeer van alle heptanen. Omdat het de meest voorkomende en commercieel waardevolle isomeer is, en ook het gemakkelijkst te synthetiseren, wordt meestal begrepen dat de term 'heptaan' uitsluitend verwijst naar n-heptaan; tenzij anders vermeld.
Op de flessen van deze vloeibare verbinding staat echter wel dat het bevat n-heptaan. Ze moeten worden blootgelegd in een afzuigkap en de metingen moeten zorgvuldig worden uitgevoerd.
Het is een uitstekend oplosmiddel voor vetten en oliën, daarom wordt het vaak gebruikt bij de extractie van plantenextracten of andere natuurlijke producten..
Artikel index
- 1 Structuur
- 1.1 n-heptaan en zijn intermoleculaire interacties
- 1.2 Isomeren
- 2 Eigenschappen van heptaan
- 2.1 Fysiek uiterlijk
- 2.2 Molaire massa
- 2.3 Smeltpunt
- 2.4 Kookpunt
- 2.5 Dampspanning
- 2.6 Dichtheid
- 2.7 Oplosbaarheid in water
- 2.8 Oplosbaarheid in andere oplosmiddelen
- 2.9 Brekingsindex (nD)
- 2.10 Viscositeit
- 2.11 Warmtecapaciteit
- 2.12 Vlampunt
- 2.13 Zelfontbrandingstemperatuur
- 2.14 Oppervlaktespanning
- 2.15 Verbrandingswarmte
- 2.16 Reactiviteit
- 3 toepassingen
- 3.1 Oplosmiddel en reactiemedium
- 3.2 Neerslagmiddel
- 3.3 octaan
- 4 referenties
Structuur
n-heptaan en zijn intermoleculaire interacties
Zoals te zien is in de eerste afbeelding, is het molecuul van n-Heptaan is lineair en door de chemische hybridisatie van zijn koolstofatomen neemt de ketting een zigzagvorm aan. Dit molecuul is dynamisch, omdat zijn C-C-bindingen kunnen roteren, waardoor de ketting lichtjes buigt onder verschillende hoeken. Dit draagt bij aan hun intermoleculaire interacties..
De n-heptaan is een apolair, hydrofoob molecuul en daarom zijn zijn interacties gebaseerd op de Londense dispersiekrachten; Dit zijn degenen die afhankelijk zijn van de molecuulmassa van de verbinding en het contactoppervlak. Twee moleculen van n-heptaan benaderen elkaar op een zodanige manier dat ze hun kettingen op elkaar "wiggen".
Deze interacties zijn effectief genoeg om de moleculen van te houden n-Heptaan samenhangend in een vloeistof die kookt bij 98 ºC.
Isomeren
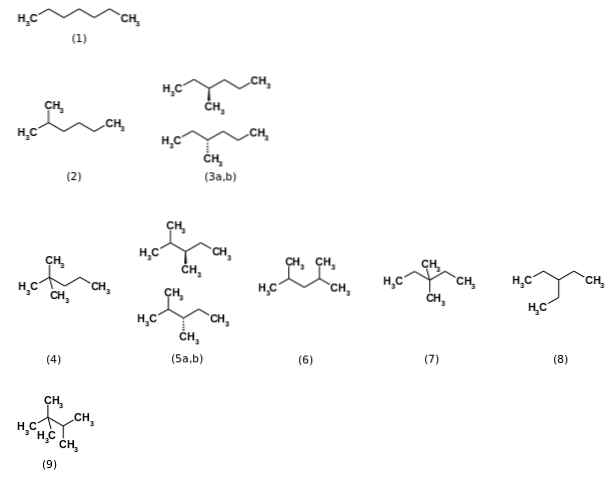
In eerste instantie werd er gezegd dat de formule C7H.16 vertegenwoordigde in totaal negen structurele isomeren, zijnde de n-heptaan het meest relevant (1). De andere acht isomeren worden weergegeven in de bovenstaande afbeelding. Merk in één oogopslag op dat sommige meer vertakt zijn dan andere. Van links naar rechts, vanaf de bovenkant, hebben we:
(2): 2-methylhexaan
(3): 3-methylhexaan, bestaande uit een paar enantiomeren (a en b)
(4): 2,2-dimethylpentaan, ook bekend als neoheptaan
(5): 2,3-dimethylpentaan, wederom met een paar enantiomeren
(6): 2,4-dimethylpentaan
(7): 3,3-dimethylpentaan
(8): 3-ethylpentaan
(9): 2,2,3-trimethylbutaan.
Elk van deze isomeren heeft eigenschappen en toepassingen die onafhankelijk zijn van de n-heptaan, voornamelijk gereserveerd voor organische synthesegebieden.
Heptaan eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof met een benzine-achtige geur.
Molaire massa
100,205 g / mol
Smeltpunt
-90.549 ºC, en wordt een moleculair kristal.
Kookpunt
98,38 ºC.
Dampdruk
52,60 atm bij 20 ° C. Merk op hoe hoog de dampspanning is, ondanks dat het minder vluchtig is dan andere paraffinische oplosmiddelen, zoals hexaan en pentaan..
Dichtheid
0,6795 g / cm3. Aan de andere kant zijn heptaandampen 3,45 keer dichter dan lucht, wat betekent dat de dampen blijven hangen in ruimtes waar een beetje van de vloeistof wordt gemorst..
Oplosbaarheid in water
Heptaan is een hydrofobe verbinding en lost nauwelijks op in water om een oplossing te verkrijgen met een concentratie van 0,0003% bij een temperatuur van 20 ºC..
Oplosbaarheid in andere oplosmiddelen
Heptaan is mengbaar met tetrachloorkoolstof, ethanol, aceton, petroleumether en chloroform..
Brekingsindex (nD
1.3855.
Viscositeit
0,389 mPa · s
Warmte capaciteit
224,64 J / K mol
ontstekingspunt
-4 ºC
Zelfontbranding temperatuur
223 ºC
Oppervlaktespanning
19,66 mN / m bij 25 ºC
Verbrandingswarmte
4817 kJ / mol.
Reactiviteit
Heptaandampen reageren in de buurt van een warmtebron (een vlam) exotherm en krachtig met de zuurstof in de lucht:
C7H.16 + 11Otwee => 7COtwee + 8HtweeOF
Buiten de verbrandingsreactie is heptaan echter een redelijk stabiele vloeistof. Het gebrek aan reactiviteit is te wijten aan het feit dat de C-H-bindingen moeilijk te verbreken zijn, dus het is niet vatbaar voor substituties. Evenzo is het niet erg gevoelig voor sterke oxidatiemiddelen, zolang er geen vuur in de buurt is..
Het grootste gevaar van heptaan is zijn hoge vluchtigheid en ontvlambaarheid, dus er is een risico op brand als het op hete plaatsen wordt gemorst.
Toepassingen
Oplosmiddel en reactiemedium

Het hydrofobe karakter van heptaan maakt het een uitstekend oplosmiddel voor het oplossen van oliën en vetten. In dit aspect is het gebruikt als ontvetter. De grootste toepassing ervan ligt echter in het gebruik als extractiemiddel, omdat het zowel de lipidecomponenten als de andere organische verbindingen van een monster oplost..
Als u bijvoorbeeld alle componenten van gemalen koffie wilt extraheren, wordt deze gemacereerd in heptaan in plaats van water. Deze methode en zijn variaties zijn geïmplementeerd met alle soorten zaden, waardoor plantenextracten en andere natuurlijke producten zijn verkregen..
Heptaan, dat van nature kleurloos is, zal verkleuren naar de kleur van de gewonnen olie. Vervolgens wordt het gedraaid om uiteindelijk een zo zuiver mogelijk volume van de olie te krijgen..
Aan de andere kant maakt de lage reactiviteit van heptaan het ook een optie bij het overwegen van een reactiemedium om een synthese uit te voeren. Omdat het een goed oplosmiddel is voor organische verbindingen, zorgt het ervoor dat de reagentia in oplossing blijven en op de juiste manier met elkaar reageren terwijl ze reageren.
Neerslagmiddel
In de petroleumchemie is het gebruikelijk om asfaltenen uit een ruw monster neer te slaan door heptaan toe te voegen. Met deze methode kan de stabiliteit van verschillende ruwe oliën worden bestudeerd en kan worden bepaald hoe vatbaar hun asfalteengehalte is om te neerslaan en een hele reeks problemen voor de olie-industrie te veroorzaken..
Octaan
Heptaan is gebruikt als brandstof vanwege de grote hoeveelheid warmte die het afgeeft bij verbranding. Wat automotoren betreft, zou het echter nadelig zijn voor hun prestaties als het in zuivere vorm wordt gebruikt. Omdat het zeer explosief brandt, dient het om 0 te definiëren op de schaal van het octaangetal voor benzine..
Benzine bevat een hoog percentage heptaan en andere koolwaterstoffen om het octaangetal op bekende waarden te brengen (91, 95, 87, 89, etc.).
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. (10e editie.). Wiley plus.
- Wikipedia. (2020). Heptaan. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2020). Heptane PubChem-database. CID = 8900. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptanen ScienceDirect. Hersteld van: sciencedirect.com
- Bell Chem Corp. (7 september 2018). Industrieel gebruik van heptaan. Hersteld van: bellchem.com
- Andrea Kropp. (2020). Heptaan: structuur, gebruik en formule. Studie. Hersteld van: study.com



Niemand heeft nog op dit artikel gereageerd.