
Hexaan (C6H14) fysische en chemische eigenschappen, structuur, gebruik, toxiciteit
De hexaan is een koolwaterstof die wordt gekenmerkt doordat het een organische verbinding is waarvan de gecondenseerde chemische formule C is6H.14. Het is een kleurloze, transparante vloeistof die niet met water kan worden gemengd. Het heeft vijf isomeren, waarvan de lineaire een van de belangrijkste paraffinische koolwaterstoffen in industrie en onderzoek is.
Hexaan wordt verkregen door gefractioneerde destillatie van ruwe olie. Evenzo is het van nature aanwezig in citrusvruchten en in vluchtige fracties van verschillende planten of vruchten zoals appel, guave, geroosterde hazelnoten, zoete aardappel en salie..
Het is een licht ontvlambare vluchtige vloeistof die voorkomt in benzine, sneldrogende lijmen en rubbercement. Hexaan wordt gebruikt als oplosmiddel bij het extractieproces van plantaardige oliën, evenals lipiden en vetten die aanwezig zijn in vervuild water en bodems.
Mensen die beroepsmatig aan hexaan worden blootgesteld, kunnen schade aan het perifere zenuwstelsel ervaren, wat zich uit in tintelingen en krampen in de benen en armen; naast gegeneraliseerde spierzwakte en, in ernstige gevallen, skeletspieratrofie.
Artikel index
- 1 Fysische en chemische eigenschappen van hexanen
- 1.1 Fysiek uiterlijk
- 1,2 molaire massa
- 1.3 Geur
- 1.4 Geurdrempelwaarde
- 1.5 Dichtheid
- 1.6 Smeltpunt
- 1.7 Kookpunt
- 1.8 Vlampunt
- 1.9 Oplosbaarheid in water
- 1.10 Oplosbaarheid in oplosmiddelen
- 1.11 Relatieve dampdichtheid met lucht
- 1.12 Verdelingscoëfficiënt octanol / water
- 1.13 Dampspanning
- 1.14 Golflengte met maximale optische dichtheid
- 1.15 Brekingsindex
- 1.16 Viscositeit
- 1.17 Calorische capaciteit
- 1.18 Verbrandingswarmte
- 1.19 Verdampingswarmte
- 1.20 Oppervlaktespanning
- 1.21 Ionisatiepotentieel
- 1.22 Stabiliteit
- 1.23 Reactiviteit
- 2 Structuur van hexaan
- 2.1 Intermoleculaire interacties
- 2.2 Isomeren
- 3 toepassingen
- 4 Toxiciteit
- 4.1 Inademing en contact
- 4.2 Veilige dosis
- 5 referenties
Fysische en chemische eigenschappen van hexanen
Fysiek uiterlijk
Kleurloze, transparante en zeer vluchtige vloeistof.
Molaire massa
86,178 g / mol
Geur
Vergelijkbaar met benzine
Geurdrempel
1,5 ppm
Dichtheid
0,6606 g / ml
Smeltpunt
-96 tot -94 ºC
Kookpunt
68,5 tot 69,1 ºC
ontstekingspunt
-22 ºC (gesloten beker).
Oplosbaarheid in water
9,5 mg / L (praktisch niet mengbaar met water)
Oplosbaarheid in oplosmiddelen
Zeer oplosbaar in ethanol, oplosbaar in ethylether en chloroform. Mengbaar met alcohol, chloroform en ether.
Relatieve dampdichtheid met lucht
2,97 (lucht = 1)
Verdelingscoëfficiënt octanol / water
Log P = 3764
Dampdruk
17,60 kPa bij 20 ºC
Golflengte met maximale optische dichtheid
200 nm
Brekingsindex
1.375
Viscositeit
0,3 mPa s
Calorische capaciteit
265,2 JK-1Mol-1
Verbrandingswarmte
4.163,2 kJ mol-1
Warmte van verdamping
31,56 kJ mol-1
Oppervlaktespanning
17,89 mN / m bij 25 ºC
Ionisatiepotentieel
10.18 eV
Stabiliteit
Stal. Onverenigbaar met oxidatiemiddelen, chloor, fluor, magnesiumperchloraat. Vormt een explosief mengsel met lucht.
Reactiviteit
Hexaan kan heftig reageren met oxiderende materialen, waaronder vloeibaar chloor, geconcentreerde zuurstof, natriumhypochloriet en calciumhypochloriet. Het is ook onverenigbaar met distikstoftetroxide. Hexaan kan sommige soorten kunststoffen, rubber en coatings aantasten.
Structuur van hexaan
Intermoleculaire interacties
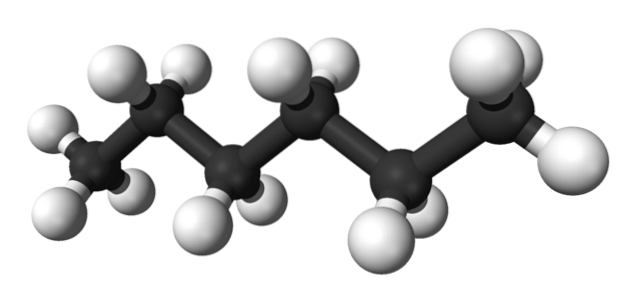
De eerste afbeelding toont het molecuul van n-hexaan weergegeven door een ball-and-stick-model. De zwarte bollen komen overeen met de koolstofatomen en vormen het zigzaggende koolstofskelet, terwijl de witte bollen de waterstofatomen zijn. De n-Hexaan is daarom een koolwaterstof, lineair en zeer dynamisch.
Omdat al zijn C-H-bindingen een lage polariteit hebben, mist het molecuul een dipoolmoment. Daarbij zijn hun intermoleculaire interacties niet van het dipool-dipooltype, maar uitsluitend afhankelijk van de molecuulmassa en de dispergerende krachten van Londen..
Elk molecuul van n-Hexaan "past" op elkaar bij zeer lage temperaturen, zoals zou worden aangenomen in zijn kristallijne structuur. Aan de andere kant buigen en roteren hun skeletten in de vloeistof hun C-H-bindingen, waardoor de vloeistof vluchtig is en kookt bij 68,7 ºC..
Isomeren
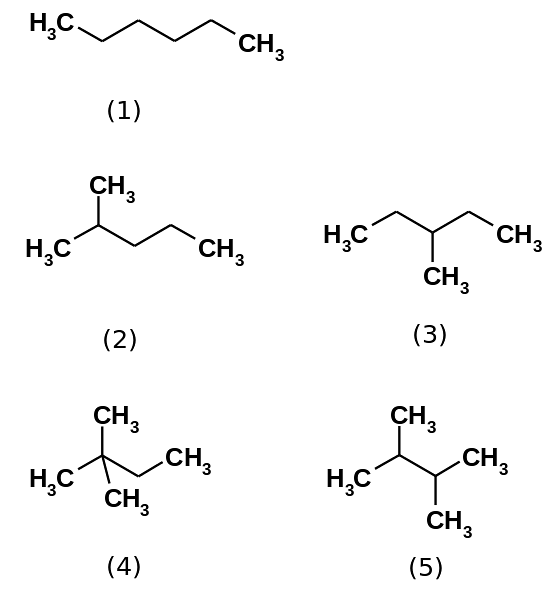
De koolwaterstofhexaan bestaat eigenlijk uit vijf isomeren, zijnde de n-hexaan het minst vertakt, (1). De andere vier isomeren zijn, in oplopende volgorde:
2-methylpropaan (2)
3-methylpropaan (3)
2,2-dimethylbutaan (4)
2,3-dimethylbutaan (5)
Merk ook op dat de structuren meer vertakt worden van (1) tot (5). Omdat ze meer vertakt zijn, nemen de dispergerende krachten af, omdat er niet langer lineaire delen zijn die efficiënt wiggen. Dit leidt tot een afname en variatie in de kookpunten van de isomeren; hoewel er enkele aanvaardbare verschillen worden waargenomen.
Zowel 2-methylpropaan (kookpunt = 60,3 ° C) als 3-methylpropaan (kookpunt = 63,3 ° C) zijn even vertakt, maar hun kookpunten zijn verschillend. Daarna wordt het gevolgd door 2,3-dimethylbutaan (peb = 58 ºC), om uiteindelijk 2,2-dimethylbutaan te lokaliseren als de meest vluchtige vloeistof (peb = 49,7 ºC).
Toepassingen
Hexaan wordt gemengd met vergelijkbare chemicaliën om oplosmiddelen te produceren. Onder de namen die aan deze oplosmiddelen worden gegeven, zijn commerciële hexaan, gemengde hexanen, enz. Ze worden gebruikt als reinigingsmiddelen in de textiel-, meubel- en diepdrukindustrie..
Hexaan is een ingrediënt in lijmen die worden gebruikt voor het waterdicht maken van daken, schoeisel en leer. Het wordt ook gebruikt voor het binden van boeken, voor het vormen van pillen en tabletten, inblikken, het maken van banden en honkballen..
Hexaan wordt gebruikt bij de bepaling van de brekingsindex van mineralen en vulvloeistof voor thermometers in plaats van kwik; meestal met een rode of blauwe tint. Het wordt ook gebruikt bij de extractie van vet en olie uit water voor de analyse van de verontreinigingen..
Hexaan wordt gebruikt als oplosmiddel bij de extractie van olie uit groentezaden, zoals sojabonen, koolzaad of braam. Bovendien wordt het gebruikt om onderdelen van verschillende oorsprong te ontvetten. Het wordt gebruikt bij de denaturatie van alcohol, bij de HPLC-analysemethode en bij spectrofotometrie.
Toxiciteit
Inademing en contact
De acute toxiciteit van hexaan is relatief laag, hoewel het een mild anestheticum is. Acute blootstelling aan hoge concentraties hexaan kan bij inademing een milde depressie van het centrale zenuwstelsel (CZS) veroorzaken, die zich manifesteert door duizeligheid, draaierigheid, milde misselijkheid en hoofdpijn..
Het kan ook dermatitis en irritatie van de ogen en keel veroorzaken. Chronische inademing van hexaan, gerelateerd aan werkactiviteit, kan schade aan het perifere zenuwstelsel veroorzaken (sensorimotorische polyneuropathie).
De eerste symptomen zijn tintelingen en krampen in de benen en armen, gevolgd door spierzwakte. In ernstige gevallen kan skeletspieratrofie optreden, samen met verlies van coördinatie en zichtproblemen.
De toxiciteit van hexaan houdt verband met de vorming van de metaboliet hexaan-2,5-dion. Het reageert met het aminozuur lysine van een eiwitzijketen, waardoor de eiwitfunctie verloren gaat..
Veilige dosis
De Enviromental Protection Agency (EPA) berekende een referentieconcentratie (RfC) voor hexaan van 0,2 mg / m3, en een referentiedosis (RfD) van 0,06 mg / kg lichaamsgewicht / dag.
In de jaren zestig en zeventig had een groep arbeiders in de schoenindustrie in Japan last van zenuwaandoeningen. De oorzaak was dat ze 8-14 uur per dag in een hexaanatmosfeer van 500 - 2.500 ppm ademden.
De arbeiders vertoonden de bekende symptomen van chronische inademing van hexaan en ontdekten de artsen dat de zenuwen die de spieren van de armen en benen aanstuurden beschadigd waren..
Referenties
- Danielle Reid. (2019). Hexaan: structuur, formule en eigenschappen. Studie. Hersteld van: study.com
- Nationaal centrum voor informatie over biotechnologie. (2019). Hexaan. PubChem-database. CID = 8058. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Hexaan. Hersteld van: en.wikipedia.org
- Wereld van moleculen. (s.f.). Hexaan molecuul. Hersteld van: worldofmolecules.com
- Chemisch boek. (2017). Hexaan. Hersteld van: chemicalbook.com
- Gemenebest van Australië. (s.f.). n-hexaan: bronnen van emissies. Hersteld van: npi.gov.au
- EPA. (2000). Hexaan. [Pdf]. Hersteld van: epa.gov
- Agentschap voor giftige stoffen en ziekteregistratie. (1999). Volksgezondheidsverklaring voor n-hexaan. Hersteld van: atsdr.cdc.gov


Niemand heeft nog op dit artikel gereageerd.