
Berylliumhydride (BeH2) structuur, eigenschappen en toepassingen
De berylliumhydride Het is een covalente verbinding gevormd tussen het aardalkalimetaal beryllium en waterstof. De chemische formule is BeHtwee, en omdat het covalent is, bestaat het niet uit Be-ionentwee+ noch H-. Het is, samen met LiH, een van de lichtste metaalhydriden die kunnen worden gesynthetiseerd.
Het wordt geproduceerd door dimethylberyllium, Be (CH3twee, met lithiumaluminiumhydride, LiAlH4. De BeHtwee zuiverder wordt verkregen uit de pyrolyse van di-tert-butylberyl, Be (C (CH33twee bij 210 ºC.

Als een individueel molecuul in gasvormige toestand is het lineair van geometrie, maar in vaste en vloeibare toestand polymeriseert het in reeksen driedimensionale netwerken. Het is onder normale omstandigheden een amorfe vaste stof en kan onder enorme druk kristallijn worden en metallische eigenschappen vertonen..
Het vertegenwoordigt een mogelijke methode om waterstof op te slaan, hetzij als waterstofbron bij het uiteenvallen, hetzij als vast absorberend gas. De BeHtwee het is zeer giftig en vervuilend gezien de sterk polariserende aard van beryllium.
Artikel index
- 1 Chemische structuur
- 1.1 BeH2-molecuul
- 1.2 BeH2-ketens
- 1.3 Driedimensionale netwerken van BeH2
- 2 Eigenschappen
- 2.1 Covalent karakter
- 2.2 Chemische formule
- 2.3 Fysiek uiterlijk
- 2.4 Oplosbaarheid in water
- 2.5 Oplosbaarheid
- 2.6 Dichtheid
- 2.7 Reactiviteit
- 3 toepassingen
- 4 referenties
Chemische structuur
BeH-molecuultwee
De eerste afbeelding toont een enkel molecuul berylliumhydride in gasvormige toestand. Merk op dat de geometrie lineair is, met de H-atomen van elkaar gescheiden door een hoek van 180º. Om deze geometrie te verklaren, moet het Be-atoom sp-hybridisatie hebben.
Beryllium heeft twee valentie-elektronen, die zich in de 2s-orbitaal bevinden. Volgens de valentiebindingstheorie wordt een van de elektronen in de 2s-orbitaal energetisch gepromoveerd tot de 2p-orbitaal; en als gevolg daarvan kun je nu twee covalente bindingen vormen met de twee sp hybride orbitalen.
En hoe zit het met de rest van de vrije orbitalen van de Be? Er zijn twee andere pure, niet-gehybridiseerde 2p-orbitalen beschikbaar. Met hen leeg, de BeHtwee Het is een elektron-deficiënte verbinding in gasvorm; en daarom, als de moleculen ervan afkoelen en samenklonteren, condenseren ze en kristalliseren ze tot een polymeer.
BeH ketenstwee
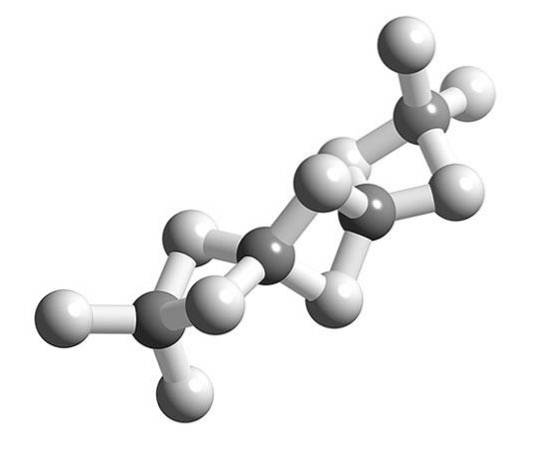
Wanneer de BeH-moleculentwee polymeriseren, houdt de omringende geometrie van het Be-atoom op lineair te zijn en wordt deze tetraëdrisch.
Eerder werd de structuur van dit polymeer gemodelleerd alsof het ketens waren met BeH-eenhedentwee verbonden door waterstofbruggen (bovenste afbeelding, met de bollen in witte en grijsachtige tinten). In tegenstelling tot de waterstofbruggen van dipool-dipool-interacties, hebben ze een covalent karakter.
In de Be-H-Be-brug van het polymeer zijn twee elektronen verdeeld over de drie atomen (link 3c, 2e), die theoretisch met een grotere waarschijnlijkheid rond het waterstofatoom zou moeten worden gelokaliseerd (omdat het meer elektronegatief is).
Aan de andere kant slaagt de Be omringd door vier H's erin om zijn elektronische vacature relatief te vullen, waarmee hij zijn valentie-octet voltooit..
Hier verbleekt de valentiebindingstheorie om een relatief nauwkeurige verklaring te geven. Waarom? Omdat waterstof maar twee elektronen kan hebben, en de -H- binding zou de deelname van vier elektronen impliceren.
Dus om de Be-H-bruggen uit te leggentwee-Be (twee grijze bollen verbonden door twee witte bollen) zijn andere complexe modellen van de binding nodig, zoals die worden geboden door de moleculaire orbitaaltheorie.
Experimenteel is gevonden dat de polymere structuur van BeHtwee eigenlijk geen ketting, maar een driedimensionaal netwerk.
Driedimensionale netwerken van BeHtwee

De bovenste afbeelding toont een deel van het driedimensionale netwerk van BeHtwee. Merk op dat de geelgroene bollen, de Be-atomen, een tetraëder vormen zoals in de ketting; in deze structuur is er echter een groter aantal waterstofbruggen en bovendien is de structurele eenheid niet langer de BeHtwee maar de BeH4.
Dezelfde structurele eenheden BeHtwee en BeH4 geven aan dat er een grotere overvloed aan waterstofatomen in het netwerk is (4 H-atomen voor elke Be).
Dit betekent dat beryllium binnen dit netwerk zijn elektronische vacature nog meer weet te bevoorraden dan binnen een kettingachtige polymere structuur..
En als het meest voor de hand liggende verschil van dit polymeer met betrekking tot het individuele molecuul van BeHtwee, is dat de Be noodzakelijkerwijs een sp-hybridisatie moet hebben3 (meestal) om tetraëdrische en niet-lineaire geometrieën uit te leggen.
Eigendommen
Covalent karakter
Waarom is berylliumhydride een covalente en niet-ionische verbinding? De hydriden van de andere elementen van groep 2 (Mr.Becamgbara) zijn ionisch, dat wil zeggen, ze bestaan uit vaste stoffen gevormd door een kation Mtwee+ en twee hydride-anionen H- (MgHtwee, CaHtwee, BahtweeDaarom is de BeHtwee bestaat niet uit Betwee+ noch H- elektrostatisch op elkaar inwerken.
Het kation Betwee+ het wordt gekenmerkt door zijn hoge polariserende vermogen, dat de elektronische wolken van de omringende atomen vervormt.
Als gevolg van deze vervorming worden de anionen H- ze worden gedwongen om covalente banden te vormen; links, die de hoeksteen vormen van de zojuist toegelichte structuren.
Chemische formule
BeHtwee of (BeHtwee) n
Fysiek uiterlijk
Kleurloze amorfe vaste stof.
Oplosbaarheid in water
Het valt uiteen.
Oplosbaarheid
Onoplosbaar in diethylether en tolueen.
Dichtheid
0,65 g / cm3 (1,85 g / l). De eerste waarde kan verwijzen naar de gasfase en de tweede naar de polymere vaste stof.
Reactiviteit
Reageert langzaam met water, maar wordt snel gehydrolyseerd door HCl om berylliumchloride, BeCl, te vormentwee.
Berylliumhydride reageert met Lewis-basen, in het bijzonder trimethylamine, N (CH33, om een dimeer adduct te vormen, met overbruggende hydriden.
Het kan ook reageren met dimethylamine om trimeer berylliumdiamide te vormen, [Be (N (CH3tweetwee3 en waterstof. De reactie met lithiumhydride, waarbij het H-ion- is de Lewis-base, vormt achtereenvolgens LIBeH3 en LitweeBeH4.
Toepassingen
Berylliumhydride zou een veelbelovende manier kunnen zijn om moleculaire waterstof op te slaan. Als het polymeer uiteenvalt, komt er H vrijtwee, die zou dienen als raketbrandstof. Vanuit deze benadering zou het driedimensionale netwerk meer waterstof opslaan dan de ketens.
Evenzo, zoals te zien is in de afbeelding van het netwerk, zijn er poriën waardoor de H-moleculen kunnen worden gehuisvest.twee.
Sommige onderzoeken simuleren zelfs hoe een dergelijke fysieke opslag eruit zou zien in BeHtwee kristallijn; dat wil zeggen, het polymeer werd blootgesteld aan enorme drukken en wat zouden zijn fysische eigenschappen zijn met verschillende hoeveelheden geadsorbeerde waterstof.
Referenties
- Wikipedia. (2017). Berylliumhydride. Hersteld van: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Theoret. Chim. Acta (1979) De elektronische structuren van polymeer berylliumhydride en polymeer boorhydride. 51: 163. doi.org/10.1007/BF00554099
- Hoofdstuk 3: Berylliumhydride en zijn oligomeren. Hersteld van: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger en U. P. Verma. (2014). Studie van structureel en elektronisch gedrag van BeHtwee als waterstofopslagverbinding: een aanpak van Ab Initio. Conference Papers in Science, vol. 2014, artikel-ID 807893, 5 pagina's. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Anorganische scheikunde. In The elements of group 1. (Vierde editie). Mc Graw Hill.


Niemand heeft nog op dit artikel gereageerd.