
Nitrobenzeen (C6H5NO2) structuur, eigenschappen, gebruik, risico's
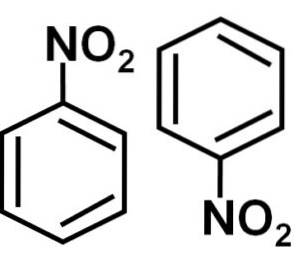
De nitrobenzeen is een aromatische organische verbinding gevormd door een benzeenring C6H.5- en een nitro-NO-groeptwee. De chemische formule is C6H.5NIETtwee. Het is een kleurloze of lichtgele olieachtige vloeistof die naar bittere amandelen of schoensmeer ruikt..
Nitrobenzeen is een zeer nuttige verbinding in de chemische industrie omdat het het mogelijk maakt om een reeks chemische stoffen te verkrijgen die verschillende toepassingen hebben. Dit komt omdat het kan worden onderworpen aan verschillende soorten reacties.
Belangrijke chemische reacties zijn onder meer nitratie (waardoor meer -NO-groepen kunnen worden toegevoegdtwee naar het molecuul) en reductie (het tegenovergestelde van oxidatie aangezien de twee zuurstofatomen van de nitro-NO-groep worden geëlimineerdtwee en zijn vervangen door waterstofatomen).
Met nitrobenzeen kunnen bijvoorbeeld aniline en para-acetaminofenol worden bereid. Dit laatste is het bekende paracetamol, een koortswerend middel (geneesmiddel tegen koorts) en licht analgeticum (geneesmiddel tegen lichte pijn)..
Nitrobenzeen moet met de nodige voorzichtigheid worden gehanteerd, aangezien het irriterend en giftig is, een vorm van bloedarmoede kan veroorzaken, naast verschillende symptomen, en er wordt aangenomen dat het kanker veroorzaakt. Het is ook schadelijk voor het milieu.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Vlampunt
- 3.6 Zelfontbrandingstemperatuur
- 3.7 Dichtheid
- 3.8 Oplosbaarheid
- 3.9 Chemische eigenschappen
- 3.10 Dimeervorming
- 3.11 Overige eigenschappen
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Bij het verkrijgen van aniline en paracetamol
- 5.2 Bij het verkrijgen van andere chemische verbindingen
- 5.3 In verschillende toepassingen
- 6 Risico's
- 7 Behandelingen voor de verwijdering uit het milieu
- 8 referenties
Structuur
Nitrobenzeen C6H.5-NIETtwee is een plat molecuul gevormd door een benzeenring C6H.5- waaraan een nitro-NO-groep is gehechttwee. Het molecuul is plat omdat er een elektronische interactie is tussen de nitro-NO-groeptwee en de benzeenring.
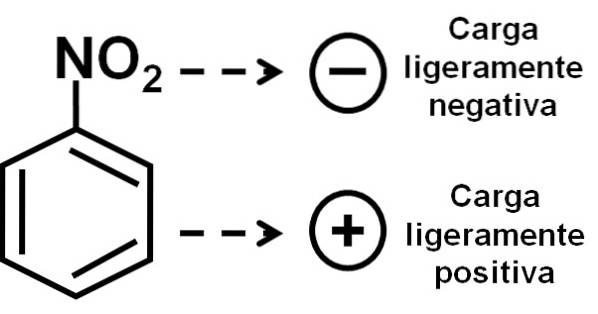
De nitro-NO-groeptwee heeft de neiging elektronen aan te trekken uit de benzeenring C6H.5-.
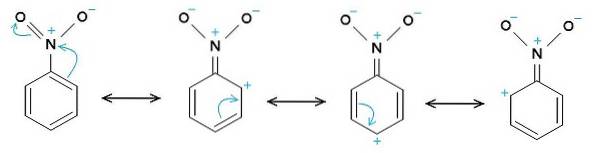
Daarom heeft het molecuul een iets meer negatieve kant (waar de zuurstofatomen van -NOtwee) en een iets positievere kant (de benzeenring).
Nomenclatuur
- Nitrobenzeen.
- Nitrobenzine.
- Nitrobenzol.
- Myrban of myrban olie of essentie (niet meer gebruikte term).
Eigendommen
Fysieke toestand
Kleurloze tot lichtgele olieachtige vloeistof.
Molecuulgewicht
123,11 g / mol.
Smeltpunt
5,7 ºC.
Kookpunt
211 ºC.
Vlampunt
88 ºC (methode met gesloten kroes).
Zelfontbranding temperatuur
480 ° C.
Dichtheid
1,2037 g / cm3 bij 20 ºC.
Oplosbaarheid
Enigszins oplosbaar in water: 0,19 g / 100 g water bij 20 ° C. Volledig mengbaar met alcohol, benzeen en diethylether.
Chemische eigenschappen
Nitrobenzeen is stabiel tot een temperatuur van ongeveer 450 ° C, waarbij het begint te ontbinden en vormt (in afwezigheid van zuurstof) NO, NOtwee, benzeen, bifenyl, aniline, dibenzofuran en naftaleen.
Belangrijke nitrobenzeenreacties zijn onder meer reductie, nitrering, halogenering en sulfonering..
Bij nitratie van nitrobenzeen ontstaat aanvankelijk metha-nitrobenzeen en bij een langere reactietijd wordt 1,3,5-nitrobenzeen verkregen.
Door broom of chloor te laten reageren met nitrobenzeen in aanwezigheid van een geschikte katalysator, wordt 3-broom-nitrobenzeen (meta-broomnitrobenzeen) of 3-chloor-nitrobenzeen (meta-chloornitrobenzeen) verkregen..
Een voorbeeld van reductie is dat bij behandeling met tin (Sn) in zoutzuur (HCl) de meta-halogeennitrobenzenen worden verkregen de meta-halogeenanilinen.
Nitrobenzeensulfonering wordt uitgevoerd met rokend zwavelzuur bij 70-80 ° C en het product is meta-nitrobenzeensulfonzuur. Dit kan worden verminderd met ijzer en HCl om methanilzuur te geven..
Dimeer vorming
In een oplossing van benzeen C6H.6 nitrobenzeenmoleculen associëren zich met elkaar om dimeren of paren van moleculen te vormen. In deze paren bevindt een van de moleculen zich in een omgekeerde positie ten opzichte van de andere..
De vorming van nitrobenzeendimeren met moleculen die een omgekeerde positie hebben ten opzichte van de andere, is mogelijk te wijten aan het feit dat elk van hen een iets positiever geladen zijde heeft en een tegenoverliggende zijde met een iets meer negatieve lading..
In het dimeer bevindt de kant met een iets positievere lading van een van de moleculen zich mogelijk dicht bij de licht negatieve lading van het andere molecuul, aangezien de tegengestelde ladingen elkaar aantrekken, en dit is het geval bij de andere twee kanten..
Andere eigenschappen
Heeft een geur die lijkt op amandelen of schoensmeer. Bij verlaging van de temperatuur stolt het in de vorm van groenachtig gele kristallen.
Het verkrijgen van
Verkregen door behandeling van benzeen C6H.6 met een mengsel van salpeterzuur HNO3 en zwavelzuur HtweeSW4. Dit proces wordt nitratie genoemd en omvat de vorming van het nitroniumion NOtwee+ dankzij de aanwezigheid van zwavelzuur HtweeSW4.
- Nitroniumion NO-vormingtwee+
HNO3 + 2 uurtweeSW4 ⇔ H3OF+ + 2 HSO4- + NIETtwee+ (nitronium-ion)
- Nitroniumion valt benzeen aan:
C6H.6 + NIETtwee+ → C6H.6NIETtwee+
- Nitrobenzeen wordt gevormd:
C6H.6NIETtwee+ + HSO4- → C6H.5NIETtwee + H.tweeSW4
Samengevat:
C6H.6 + HNO3 → C6H.5NIETtwee + H.tweeOF
De nitratiereactie van benzeen is erg exotherm, dat wil zeggen dat er veel warmte wordt gegenereerd, dus het is erg gevaarlijk.
Toepassingen
Bij het verkrijgen van aniline en paracetamol
Nitrobenzeen wordt voornamelijk gebruikt om aniline C te synthetiseren6H.5NHtwee, dit is een verbinding die veel wordt gebruikt voor de bereiding van pesticiden, tandvlees, kleurstoffen, explosieven en medicijnen.
Het verkrijgen van aniline gebeurt door nitrobenzeen te verminderen in een zuur milieu in aanwezigheid van ijzer of tin, wat wordt uitgevoerd volgens de volgende stappen:
Nitrobenzeen → Nitrosobenzeen → Fenylhydroxylamine → Aniline
C6H.5NIETtwee → C6H.5NEE → C6H.5NHOH → C6H.5NHtwee

Afhankelijk van de omstandigheden kan het proces worden gestopt in een van de tussenstappen, bijvoorbeeld fenylhydroxylamine. Uitgaande van fenylhydroxylamine in een sterk zuur medium kan para-aminofenol worden bereid:
Fenylhydroxylamine → p-Aminofenol
C6H.5NHOH → HOC6H.4NHtwee
De laatste wordt behandeld met azijnzuuranhydride om paracetamol (paracetamol) te verkrijgen, een bekend antipyretisch en mild analgeticum, dat wil zeggen een geneesmiddel om koorts en pijn te behandelen..
Een andere manier om aniline te verkrijgen is door nitrobenzeen te reduceren met koolmonoxide (CO) in een waterig medium in aanwezigheid van zeer kleine deeltjes (nanodeeltjes) palladium (Pd) als katalysator..
C6H.5-NIETtwee + 3 CO + HtweeO → C6H.5-NHtwee + 3 COtwee
Bij het verkrijgen van andere chemische verbindingen
Nitrobenzeen is het uitgangspunt om een grote verscheidenheid aan verbindingen te verkrijgen die worden gebruikt als kleurstoffen, pesticiden, medicijnen en cosmetica.

Het maakt het bijvoorbeeld mogelijk om 1,3-dinitrobenzeen te verkrijgen, dat door chlorering (toevoeging van chloor) en reductie (eliminatie van zuurstofatomen) 3-chlooraniline genereert. Dit wordt gebruikt als tussenproduct voor pesticiden, kleurstoffen en medicijnen.
Nitrobenzeen werd gebruikt om benzidine te bereiden, wat een kleurstof is. Bovendien wordt nitrobenzeen gebruikt om onder vele andere verbindingen chinoline, azobenzeen, methanilzuur, dinitrobenzeen, isocyanaten of pyroxylin te bereiden..
In verschillende toepassingen
Nitrobenzeen wordt gebruikt of is gebruikt als:
- Extractieoplosmiddel voor de zuivering van smeeroliën die in machines worden gebruikt
- Oplosmiddel voor cellulose-ethers
- Ingrediënt voor het polijsten van metaal
- In zeep
- In schoenpoetsmengsels
- Spray verf conserveermiddel
- Onderdeel van mengsels voor het polijsten van vloeren
- Amandelessentie-vervanger
- In de parfumindustrie
- Bij de productie van synthetisch rubber
- Oplosmiddel in verschillende processen

Risico's
Nitrobenzeen is giftig bij inademing, inslikken en opname via de huid..
Irriterend voor de huid, ogen en luchtwegen. Het kan een soort bloedarmoede veroorzaken die methemoglobinemie wordt genoemd, waarbij het vermogen van rode bloedcellen om zuurstof aan de weefsels af te geven wordt verminderd, wat tot vermoeidheid leidt..
Bovendien veroorzaakt nitrobenzeen kortademigheid, duizeligheid, verminderd gezichtsvermogen, kortademigheid, instorting en de dood. Het beschadigt ook de lever, milt, nieren en het centrale zenuwstelsel.
Geschat wordt dat het een mutagene stof kan zijn en mogelijk de oorzaak van kanker bij mensen, aangezien het het bij dieren heeft veroorzaakt.
Bovendien mag nitrobenzeen niet in het milieu worden weggegooid. Zijn giftigheid voor dieren, planten en micro-organismen maakt het zeer schadelijk voor ecosystemen.
Toxiciteit voor micro-organismen vermindert hun biologische afbreekbaarheid.
Behandelingen voor de verwijdering uit het milieu
Verontreiniging van het milieu met nitrobenzeen kan optreden door afval van de verschillende industrieën die het gebruiken, zoals de verf- of explosievenindustrie..
Nitrobenzeen is een zeer giftige verontreinigende stof en moeilijk te ontbinden onder natuurlijke omstandigheden, om deze reden kan het ernstige vervuiling van drinkwater en irrigatiesystemen van gewassen veroorzaken..
Vanwege zijn hoge stabiliteit en toxiciteit voor micro-organismen, wordt het vaak als model geselecteerd in rioolwaterzuiveringsonderzoeken..
Er worden verschillende manieren onderzocht om nitrobenzeen uit vervuild water te verwijderen. Een daarvan is door fotokatalytische afbraak, dat wil zeggen het gebruik van zonlicht als versneller van de afbraakreactie in aanwezigheid van titaandioxide TiOtwee.

Micro-elektrolysemethoden met een ijzer (Fe) en koper (Cu) katalysator in keramiek zijn ook met succes getest. Door micro-elektrolyse kan nitrobenzeen worden afgebroken door een elektrische stroom.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Nitrobenzeen. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. en Boyd, R.N. (2002). Organische chemie. 6e editie. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pyrolyse van andere stikstofhoudende verbindingen. In Pyrolyse van organische moleculen (tweede editie). Opgehaald van sciencedirect.com.
- Smith, P.W.G. et al. (1969). Aromatische nitratie-nitroverbindingen. Elektrofiele substituties. In Aromatische Chemie. Opgehaald van sciencedirect.com.
- Windholz, M. et al. (redactie) (1983). De Merck Index. Een encyclopedie van chemicaliën, medicijnen en biologische producten. Tiende editie. Merck & CO., Inc.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. Deel A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). UV-bestraalde fotokatalytische afbraak van nitrobenzeen door titania binding op kwartsbuis. International Journal of Photoenergy, jaargang 2012, artikel-ID 681941. Hersteld van hindawi.com.
- Shikata, T. et al. (2014). Nitrobenzeen anti-parallelle dimeervorming in niet-polaire oplosmiddelen. AIP Advances 4, 067130 (2014). Opgehaald van doaj.org.
- Krogul-Sobczak, A. et al. (2019). Reductie van nitrobenzeen tot aniline door CO / HtweeO in de aanwezigheid van palladium nanodeeltjes. Catalysts 2019, 9, 404. Hersteld van mdpi.com.
- Yang, B. et al. (2019). Productie, eigenschappen en toepassing op pilootschaal van Fe / Cu katalytisch-keramische vulstof voor afvalwaterzuivering van nitrobenzeenverbindingen. Catalysts 2019, 9, 11. Hersteld van mdpi.com.


Niemand heeft nog op dit artikel gereageerd.