
Atoomnummer
Wat is het atoomnummer?
Het atoomnummer van een chemisch element geeft het aantal protonen aan dat zich in de atoomkern van dat element bevindt. In het geval dat het een neutraal atoom was, dan zal het atoomnummer samenvallen met het aantal elektronen van dat element.
Zoals bekend bestaat de atoomkern uit protonen en neutronen. Protonen hebben een positieve lading en hun waarde valt samen met de absolute waarde van de negatieve lading van het elektron, namelijk 1,6 x 10-19 coulomb in International System-eenheden.
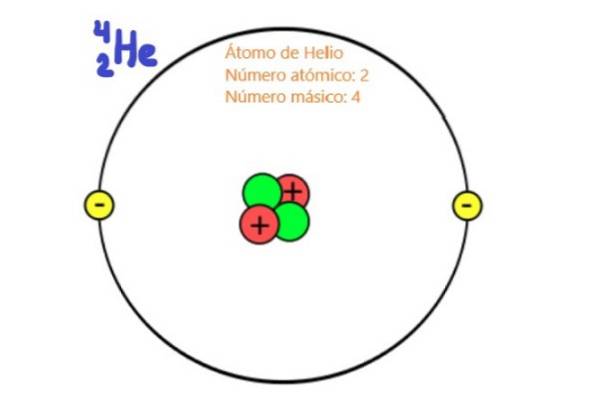
Omdat het deeltjes van de atoomkern zijn, staan protonen en neutronen bekend als nucleonen. Het zijn deze deeltjes die praktisch de massa van het atoom bepalen, aangezien de nucleonen ongeveer tweeduizend keer massiever zijn dan de elektronen van het atoom. Om deze reden wordt het aantal nucleonen in een atoom genoemd massagetal.
echter, de atoomnummer het is degene die de chemische affiniteit van de atomaire elementen bepaalt, omdat in neutrale atomen dit aantal samenvalt met het aantal elektronen.
Atoomnummervertegenwoordiging
In het periodiek systeem wordt het symbool X van een chemisch element linksonder vergezeld van het getal Z dat het atoomnummer van dat element voorstelt, terwijl het massagetal linksboven het chemische symbool van het element wordt aangegeven. NAAR.
De volgende afbeelding toont deze notatie:
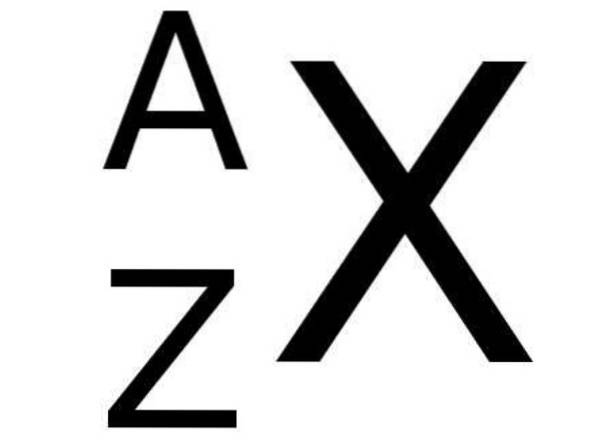
En hieronder toont tabel 1 enkele voorbeelden van chemische elementen met hun respectieve notatie en atoom- en massagetallen:
tafel 1
| Element | Notatie | Atoomnummer Z | Massa nummer A |
|---|---|---|---|
| Waterstof | 1 1 H. | 1 | 1 |
| Koolstof | 12 6 C | 6 | 12 |
| Zuurstof | 16 8 OF | 8 | 16 |
| Uranium | 238 92 OF | 92 | 238 |
Atoomnummer en volgorde van elementen in het periodiek systeem
Het periodiek systeem van chemische elementen maakt de opeenvolgende rangschikking en in oplopende volgorde van de elementen mogelijk, volgens de waarde van hun atoomnummer.
Er zijn er tenminste 118 bekend, beginnend met waterstof tot het bereiken van element 118 dat de oganeson -voordat gebeld ununoctium-, waarvan het chemische symbool Og is en het massagetal 294.
De eerste 10 chemische elementen met oplopende volgorde in atoomnummer zijn veel bekender. Zo hebben we bijvoorbeeld de bekendste:
- Waterstof, H
- Helium, He
- Lithium, Li
- Beryllium, Be
- Borium, B
- Koolstof, C
- Stikstof, N
- Zuurstof, O
- Fluor, F.
- Neon, Ne

Elektronische configuratie
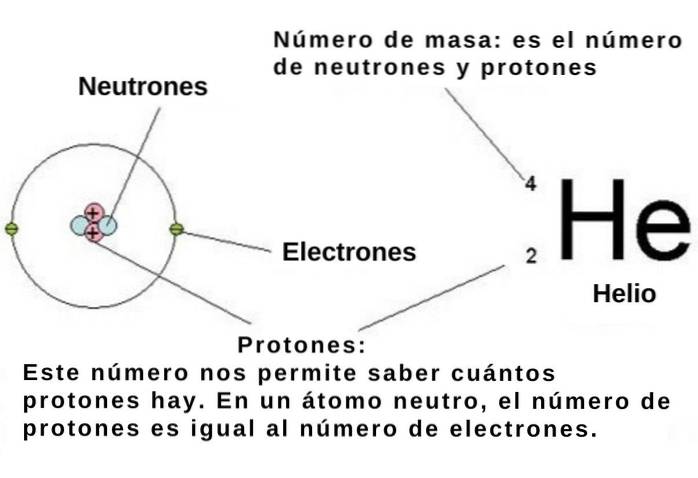
Het atoomnummer geeft het aantal protonen aan in de atoomkern van een chemisch element en elk proton heeft, zoals we al zeiden, een elementaire positieve lading van 1.602 x 10-19 C.
Als het atoom neutraal is, is het aantal negatief geladen elementaire elektronen -1,602 x 10-19 C moet gelijk zijn aan het atoomnummer. Dus als je de numerieke positie van een chemisch element in het periodiek systeem kent, is ook het aantal elektronen bekend..
In het atoom bezetten deze elektronen gebieden die worden genoemd orbitalen, die afhangen van de energie en het impulsmoment van het elektron. Op hun beurt worden zowel de energie als het impulsmoment van de elektronen in het atoom gekwantiseerd. Dit betekent dat ze slechts enkele discrete waarden kunnen aannemen.
Nu worden de orbitalen gevuld met elektronen van lagere naar hogere energie, volgens bepaalde regels die de elektronische configuratie bepalen.
Op deze manier stelt het aantal elektronen in de buitenste orbitalen of niveaus van een atoom de bindingen vast die het kan vormen met andere atomen om moleculen te vormen. Dit aantal is afhankelijk van de elektronenconfiguratie en het atoomnummer.
Kwantumgetallen
De energie van een elektron in het atoom wordt bepaald door zijn belangrijkste kwantumgetal n, die gehele getallen 1, 2, 3 ... kan aannemen
Het impulsmoment van het elektron in het atoom wordt bepaald door het secundaire kwantumgetal l (letter ele) en zijn waarden zijn afhankelijk van n.
Voor n = 2 neemt het secundaire kwantumgetal bijvoorbeeld de waarden van 0 tot n-1, dat wil zeggen: 0 en 1. Evenzo, voor n = 1, wat het laagste energieniveau is, het secundaire kwantumgetal l het alleen heeft de waarde 0.
Secundaire kwantumnummers 0, 1, 2, 3 worden afwisselend aangeduid met de letters s, p, d en f. De s-orbitalen zijn bolvormig en de p-orbitalen zijn gelobd.
Er zijn nog twee kwantumnummers:
- Het magnetische kwantumgetal ml, waarbij de waarden van -l tot + l door nul gaan.
- Het spinkwantumnummer s, die alleen waarden + ½ en -½ aanneemt en een kenmerk is van het elektron.
Ten slotte is er het uitsluitingsprincipe van Pauli, dat stelt dat twee elektronen niet alle vier identieke kwantumgetallen kunnen hebben. Als gevolg van dit principe kan een orbitaal maximaal twee elektronen met tegengestelde spin hebben.
Elektronisch configuratiediagram
Het elektronenconfiguratiediagram wordt gebruikt om de volgorde van het vullen van de elektronen te kennen van de orbitalen met de laagste energie tot de orbitalen met de hoogste energie, zodra het atoomnummer van een chemisch element bekend is. Figuur 4 toont dit diagram:
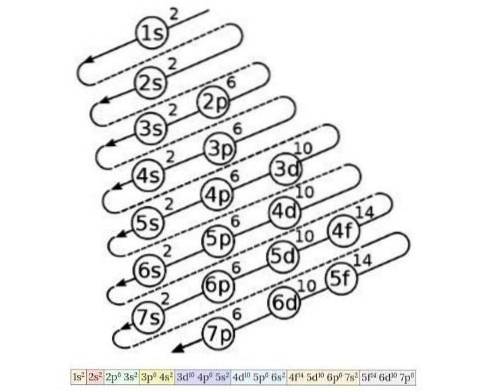
Het idee dat daar wordt geschetst, is het volgende: het eerste getal geeft het hoofdkwantumnummer aan, vervolgens geeft de letter het secundaire kwantumnummer aan en tenslotte geeft het superscriptnummer het maximale aantal elektronen aan dat mogelijk is in die baan..
Voorbeeld
Elektronische configuratie van koolstof en silicium
Zoals hierboven aangegeven, heeft koolstof atoomnummer 6, wat betekent dat het 6 elektronen heeft die als volgt zijn verdeeld: 1s2 2s2 2p2. Silicium van zijn kant heeft atoomnummer 14 en zijn elektronen zijn op deze andere manier verdeeld: 1s2 2s2 2p6 3s2 3p2.
Beide elementen staan in dezelfde kolom van het periodiek systeem, want hoewel ze verschillende atoomnummers hebben, hebben ze dezelfde elektronische configuratie in het periodiek systeem. buitenste orbitaal.
Referenties
- Connor, N. Wat is Nucleon - Structuur van atoomkernen - Definitie. Hersteld van: periodic-table.org.
- Peoples Summit. Atoomnummer: wat is het, hoe wordt het weergegeven. Hersteld van: cumbrepuebloscop20.org
- Lifeder. Wat is chemische periodiciteit? Hersteld van: lifeder.com
- Wikipedia. Elektronische configuratie. Hersteld van: es.wikipedia.com
- Wikipedia. Atoomnummer. Hersteld van: es.wikipedia.com



Niemand heeft nog op dit artikel gereageerd.