
Wat is het equivalentiepunt en waar dient het voor?
De equivalentiepunt Het is er een waarin twee chemische stoffen volledig hebben gereageerd. Bij zuur-base-reacties geeft dit punt aan wanneer een volledig zuur of base is geneutraliseerd. Dit concept is het dagelijkse brood van de titraties of volumetrische waarderingen, en wordt bepaald door middel van eenvoudige wiskundige berekeningen.
Maar wat is de graad? Het is een proces waarbij een volume van een oplossing met een bekende concentratie, titrant genaamd, voorzichtig wordt toegevoegd aan een oplossing met een onbekende concentratie om de concentratie te verkrijgen.

Door het gebruik van een pH-indicator weet je op welk moment de titratie eindigt. De indicator wordt toegevoegd aan de oplossing die wordt getitreerd om de gewenste concentratie te kwantificeren. Een zuur-base-indicator is een chemische verbinding waarvan de kleur afhangt van de waterstofconcentratie of pH van het medium..
De kleurverschuiving van de indicator geeft echter het eindpunt van de titratie aan, maar niet het equivalentiepunt. Idealiter vallen beide punten samen; maar in werkelijkheid kan de kleurverandering optreden binnen een paar druppels nadat de neutralisatie van het zuur of de base is voltooid..
Artikel index
- 1 Wat is het equivalentiepunt?
- 1.1 Eindpunt
- 2 Equivalentiepunt van de titratie van een sterk zuur met een sterke base
- 3 Zwakke zuur-sterke basetitratiecurve
- 3.1 Stadia
- 3.2 Selectie van de indicator op basis van het equivalentiepunt
- 4 referenties
Wat is het equivalentiepunt?
Een oplossing van een zuur met een onbekende concentratie die in een kolf wordt geplaatst, kan worden getitreerd door langzaam een natriumhydroxideoplossing met een bekende concentratie toe te voegen met behulp van een buret..
De selectie van een indicator moet zo worden gedaan dat deze van kleur verandert op het punt dat dezelfde hoeveelheid chemische equivalenten van de titrantoplossing en de oplossing met onbekende concentratie hebben gereageerd..
Dit is het equivalentiepunt, terwijl het punt waarop een indicator van kleur verandert, het eindpunt wordt genoemd, waar de titratie eindigt..
Laatste punt
De ionisatie of dissociatie van de indicator wordt als volgt weergegeven:
HIn + HtweeOF <=> In- + H.3OF+
En heeft daarom een constante Ka
Ka = [H3OF+] [In-] / [HIn]
De relatie tussen de niet-gedissocieerde indicator (HIn) en de gedissocieerde indicator (In-) bepaalt de kleur van de indicator.
De toevoeging van een zuur verhoogt de HIn-concentratie en geeft indicatorkleur 1. Ondertussen bevordert de toevoeging van een base een toename van de concentratie van de gedissocieerde indicator (In-) (kleur 2).
Het is wenselijk dat het equivalentiepunt overeenkomt met het eindpunt. Om dit te doen, wordt een indicator geselecteerd met een kleurveranderingsinterval dat het equivalentiepunt omvat. Bovendien probeert het eventuele fouten te verminderen die een verschil tussen het equivalentiepunt en het eindpunt veroorzaken.
De standaardisatie of titratie van een oplossing is een proces waarbij de exacte concentratie van een oplossing wordt bepaald. Het is methodologisch een graad, maar de gevolgde strategie is anders.
Een oplossing van de primaire standaard wordt in de kolf geplaatst en de titreeroplossing die wordt gestandaardiseerd wordt met een buret toegevoegd..
Equivalentiepunt van de titratie van een sterk zuur met een sterke base
100 ml 0,1 M HCl wordt in de kolf geplaatst en geleidelijk wordt een 0,1 M NaOH-oplossing door een buret toegevoegd, waarbij de pH-veranderingen worden bepaald van de oplossing die het zoutzuur voortbrengt.
Aanvankelijk voordat NaOH wordt toegevoegd, is de pH van de HCl-oplossing 1.
De sterke base (NaOH) wordt toegevoegd en de pH stijgt geleidelijk, maar het is nog steeds een zure pH, aangezien een teveel aan zuur deze pH bepaalt.
Als je doorgaat met het toevoegen van NaOH, komt er een moment dat het equivalentiepunt wordt bereikt, waarop de pH neutraal is (pH = 7). Het zuur heeft gereageerd met de base die wordt verbruikt, maar er is nog geen overtollige base.
De concentratie van natriumchloride, dat een neutraal zout is (noch Na+ noch de Cl- hydrolyseren).
Als je doorgaat met het toevoegen van NaOH, blijft de pH stijgen en wordt deze basischer dan het equivalentiepunt, omdat de concentratie NaOH overheerst..
Idealiter vindt de kleurverandering van de indicator plaats bij pH = 7; maar vanwege de scherpe vorm van de titratiecurve kan fenolftaleïne worden gebruikt dat verandert in een bleekroze kleur bij een pH van rond de 8.
Zwakke zuursterke basetitratiecurve
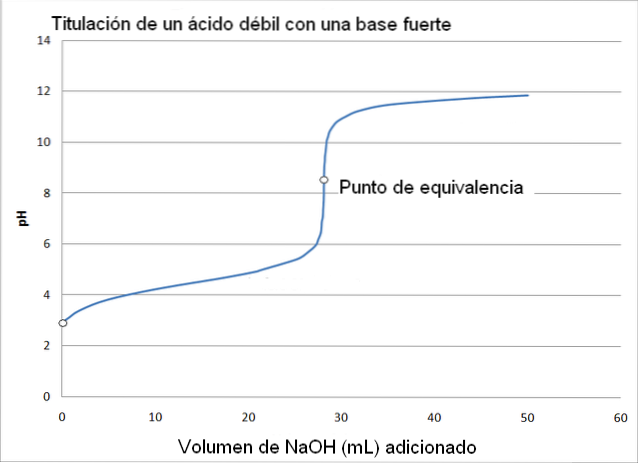
In dit geval een zwak zuur, zoals azijnzuur (CH3COOH) met een sterke base, natriumhydroxide (NaOH). De reactie die optreedt bij de titratie kan als volgt worden geschetst:
NaOH + CH3COOH => CH3COO-Na+ + H.tweeOF
In dit geval wordt de acetaatbuffer gevormd met een pKa = 4,74. Het gebufferde gebied is te zien aan de kleine en bijna onmerkbare verandering vóór pH 6.
Het equivalentiepunt, zoals de afbeelding aangeeft, is ongeveer 8,72 en niet 7. Waarom? Omdat de CH3COO- is een anion dat na hydrolyse OH genereert-, wat de pH baseert:
CH3COO- + H.tweeOF <=> CH3COOH + OH-
Stadia
De titratie van azijnzuur door natriumhydroxide kan voor analyse in 4 fasen worden verdeeld.
-Voordat u begint met het toevoegen van de base (NaOH), is de pH van de oplossing zuur en hangt af van de dissociatie van azijnzuur.
-Naarmate natriumhydroxide wordt toegevoegd, wordt de acetaatbufferoplossing gevormd, maar op dezelfde manier neemt de vorming van de acetaatconjugaatbase toe, wat een verhoging van de pH van de oplossing met zich meebrengt..
-Het equivalentiepunt pH treedt op bij een pH van 8,72, wat ronduit alkalisch is..
Het equivalentiepunt heeft geen constante waarde en varieert afhankelijk van de verbindingen die bij de titratie betrokken zijn..
-Als u doorgaat met het toevoegen van NaOH, neemt de pH toe als gevolg van een teveel aan natriumhydroxide nadat het equivalentiepunt is bereikt..
Selectie van de indicator volgens het equivalentiepunt
Fenolftaleïne is nuttig bij het bepalen van het equivalentiepunt in deze titratie, omdat het zijn kleuromslagpunt heeft bij een pH van rond de 8, die valt in de pH-zone van de azijnzuurtitratie die de puntequivalentie omvat (pH = 8,72).
Aan de andere kant is methylrood niet nuttig bij het bepalen van het equivalentiepunt, omdat het van kleur verandert in het pH-bereik van 4,5 tot 6,4.
Referenties
- Wikipedia. (2018). Equivalentiepunt. Hersteld van: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). Equivalentiepunt Definitie. Hersteld van: thoughtco.com
- Lusi Madisha. (16 april 2018). Verschil tussen eindpunt en equivalentiepunt. " DifferenceBetween.net. Hersteld van: differencebetween.net
- Kijk J. (2018). Equivalentiepunt: definitie en berekening. Hersteld van: study.com
- Whitten, K. W., Davis, R. E., Peck, L. P. & Stanley, G. G. Chemistry. (2008) Achtste editie. Cengage Learning Editors.

Niemand heeft nog op dit artikel gereageerd.