
Rubidium geschiedenis, eigenschappen, structuur, verkrijgen, gebruik
De rubidium Het is een metallisch element dat behoort tot groep 1 van het periodiek systeem: dat van de alkalimetalen, voorgesteld door het chemische symbool Rb. De naam klinkt vergelijkbaar met robijn, en het is omdat toen het werd ontdekt, het emissiespectrum karakteristieke lijnen van dieprode kleur vertoonde..
Het is een van de meest reactieve metalen die er zijn. Het is de eerste van de alkalimetalen die, ondanks dat ze niet erg dicht zijn, in water zinken. Het reageert er ook explosiever op in vergelijking met lithium, natrium en kalium. Er zijn experimenten geweest waarbij blaren barsten waar het wordt opgeslagen (onderste afbeelding) om te vallen en te exploderen in badkuipen.

Rubidium onderscheidt zich doordat het een duurder metaal is dan goud zelf; niet zozeer vanwege zijn schaarste, maar vanwege zijn brede mineralogische verspreiding in de aardkorst en de moeilijkheden die ontstaan bij het isoleren van kalium- en cesiumverbindingen..
Het vertoont een duidelijke neiging om zich te associëren met kalium in zijn mineralen, omdat het als onzuiverheden wordt aangetroffen. Niet alleen op geochemisch gebied vormt het een duo met kalium, maar ook op het gebied van biochemie.
Het organisme "verwart" de K-ionen+ door die van Rb+rubidium is tot op heden echter geen essentieel element, aangezien zijn rol in het metabolisme onbekend is. Toch zijn rubidiumsupplementen gebruikt om bepaalde medische aandoeningen zoals depressie en epilepsie te verlichten. Aan de andere kant geven beide ionen een violette vlam af aan de hitte van de aansteker.
Vanwege de hoge kosten zijn de toepassingen ervan niet te veel gebaseerd op de synthese van katalysatoren of materialen, maar als een component voor verschillende apparaten met theoretische fysische bases. Een daarvan is de atoomklok, zonnecellen en magnetometers. Dit is de reden waarom rubidium soms wordt beschouwd als een onderschat of onvoldoende bestudeerd metaal..
Artikel index
- 1 Geschiedenis
- 2 Fysische en chemische eigenschappen
- 2.1 Uiterlijk
- 2.2 Atoomnummer (Z)
- 2.3 Molaire massa
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Dichtheid
- 2.7 Warmte van fusie
- 2.8 Verdampingswarmte
- 2.9 Elektronegativiteit
- 2.10 Elektronische affiniteit
- 2.11 Ionisatie-energieën
- 2.12 Atoomradius
- 2.13 Thermische geleidbaarheid
- 2.14 Elektrische weerstand
- 2.15 Mohs-hardheid
- 2.16 Reactiviteit
- 3 Structuur en elektronische configuratie
- 3.1 oxidatienummers
- 3.2 Clusters
- 4 Waar te vinden en te verkrijgen
- 4.1 Aardkorst
- 4.2 Geochemische associatie
- 4.3 Gefractioneerde kristallisatie
- 4.4 Elektrolyse of reductie
- 5 isotopen
- 6 Risico's
- 6.1 Metaal
- 6.2 Ionen
- 7 toepassingen
- 7.1 Gascollector
- 7.2 Pyrotechniek
- 7.3 Aanvulling
- 7.4 Bose-Einstein-condensaat
- 7.5 Diagnose van tumoren
- 7.6 Component
- 7.7 Atoomklokken
- 8 referenties
Verhaal
Rubidium werd in 1861 ontdekt door de Duitse chemici Robert Bunsen en Gustav Kirchhoff met behulp van spectroscopie. Om dit te doen, gebruikten ze de bunsenbrander en de spectroscoop, twee jaar eerder uitgevonden, evenals analytische precipitatietechnieken. Zijn onderzoeksobject was het mineraal lepidoliet, waarvan het monster werd verzameld in Saksen, Duitsland.
Ze gingen uit van 150 kg lepidolietmineraal, dat ze behandelden met chloorplatinazuur, HtweePtCl6, om kaliumhexachloorplatinaat neer te slaan, KtweePtCl6. Toen ze echter het spectrum bestudeerden door het in de bunsenbrander te verbranden, realiseerden ze zich dat het emissielijnen vertoonde die op dat moment niet samenvielen met enig ander element..
Het emissiespectrum van dit nieuwe element wordt gekenmerkt door twee goed gedefinieerde lijnen in het rode gebied. Daarom doopten ze het met de naam 'rubidus' wat 'donkerrood' betekent. Later wisten Bunsen en Kirchhoff de Rb te scheidentweePtCl6 van KtweePtCl6 door gefractioneerde kristallisatie; om het uiteindelijk met waterstof te reduceren tot zijn chloridezout.
Door een zout van het nieuwe element rubidium te identificeren en te isoleren, hoefden de Duitse chemici het alleen terug te brengen tot zijn metallische staat. Om dit te bereiken probeerden ze op twee manieren: elektrolyse toepassen op rubidiumchloride, of een zout verhitten dat gemakkelijker te reduceren is, zoals het tartraat ervan. Op deze manier werd het metallische rubidium geboren.
Fysische en chemische eigenschappen
Uiterlijk
Zacht, zilvergrijs metaal. Het is zo glad dat het op boter lijkt. Het wordt meestal verpakt in glazen ampullen, waarin een inerte atmosfeer overheerst die het beschermt tegen reactie met lucht..
Atoomnummer (Z)
37
Molaire massa
85,4678 g / mol
Smeltpunt
39 ºC
Kookpunt
688 ºC
Dichtheid
Bij kamertemperatuur: 1,532 g / cm3
Op smeltpunt: 1,46 g / cm3
De dichtheid van rubidium is hoger dan die van water, dus het zal zinken terwijl het er heftig mee reageert.
Warmte van fusie
2,19 kJ / mol
Warmte van verdamping
69 kJ / mol
Elektronegativiteit
0,82 op de schaal van Pauling
Elektronische affiniteit
46,9 kJ / mol
Ionisatie-energieën
-Ten eerste: 403 kJ / mol (Rb+ gasvormig)
-Ten tweede: 2632,1 kJ / mol (Rbtwee+ gasvormig)
-Ten derde: 3859,4 kJ / mol (Rb3+ gasvormig)
Atomaire radio
248 uur (empirisch)
Warmtegeleiding
58,2 W / (mK)
Elektrische weerstand
128 nΩm bij 20 ° C
Mohs-hardheid
0,3. Daarom is zelfs talk harder dan metallisch rubidium..
Reactiviteit

Rubidium is een van de meest reactieve alkalimetalen, na cesium en francium. Zodra het aan de lucht wordt blootgesteld, begint het te branden en als het wordt geraakt, schiet het lichte vonken af. Bij verhitting geeft het ook een violette vlam af (bovenste afbeelding), wat een positieve test is voor Rb-ionen.+.
Reageert met zuurstof en vormt een mengsel van peroxiden (RbtweeOFtwee) en superoxiden (RbOtweeHoewel het niet reageert met zuren en basen, reageert het wel heftig met water, waarbij rubidiumhydroxide en waterstofgas vrijkomen:
Rb (s) + HtweeO (l) => RbOH (aq) + Htwee(g)
Reageert met waterstof om het overeenkomstige hydride te vormen:
Rb (s) + Htwee(g) => 2RbH (s)
En ook explosief met halogenen en zwavel:
2Rb (s) + Cltwee(g) => RbCl (s)
2Rb (s) + S (l) => RbtweeH.H)
Hoewel rubidium niet als een giftig element wordt beschouwd, is het potentieel gevaarlijk en vormt het brandgevaar wanneer het in contact komt met water en zuurstof..
Structuur en elektronische configuratie
De rubidium-atomen zijn zo gerangschikt dat ze een kristal vormen met een kubusvormige structuur in het lichaam (bcc, voor het acroniem in het Engels 'body centreed cubic'). Deze structuur is kenmerkend voor alkalimetalen, die licht zijn en de neiging hebben op water te drijven; behalve rubidium dons (cesium en francium).
In rubidium bcc-kristallen interageren hun Rb-atomen met elkaar dankzij de metaalbinding. Dit wordt beheerst door een "zee van elektronen" vanuit zijn valentieschil, vanuit de 5s-orbitaal volgens zijn elektronische configuratie:
[Kr] 5s1
Alle 5s-orbitalen met hun enkele elektron overlappen elkaar in alle afmetingen van metallische rubidiumkristallen. Deze interacties zijn echter zwak, omdat naarmate men door de alkalimetaalgroep afdaalt, de orbitalen diffuser worden en daarom verzwakt de metaalbinding..
Daarom is het smeltpunt van rubidium 39ºC. Evenzo verklaart zijn zwakke metaalverbinding de zachtheid van zijn vaste stof; zo zacht dat het lijkt op zilverboter.
Er is onvoldoende bibliografische informatie over het gedrag van de kristallen onder hoge druk; als er dichtere fasen zijn met unieke eigenschappen zoals natrium.
Oxidatienummers
Zijn elektronische configuratie geeft meteen aan dat rubidium sterk de neiging heeft zijn enkele elektron te verliezen om isoelektronisch te worden voor het edelgaskrypton. Als dit het geval is, wordt het eenwaardige kation Rb gevormd+. Er wordt dan gezegd dat het in zijn verbindingen oxidatiegetal +1 heeft wanneer het bestaan van dit kation wordt aangenomen.
Vanwege de neiging van rubidium om te oxideren, wordt aangenomen dat Rb-ionen bestaan+ in zijn verbindingen is correct, wat op zijn beurt het ionische karakter van deze verbindingen aangeeft.
In bijna alle rubidiumverbindingen vertoont het een oxidatiegetal van +1. Voorbeelden hiervan zijn de volgende:
-Rubidiumchloride, RbCl (Rb+Cl-
-Rubidiumhydroxide, RbOH (Rb+ Oh-
-Rubidiumcarbonaat, RbtweeCO3 (Rbtwee+CO3twee-
-Rubidiummonoxide, RbtweeO (Rbtwee+OFtwee-
-Rubidium superoxide, RbOtwee (Rb+OFtwee-
Hoewel het zeer zeldzaam is, kan rubidium ook een negatief oxidatiegetal hebben: -1 (Rb-In dit geval zouden we spreken van een ‘rubidide’ als het een verbinding vormde met een element dat minder elektronegatief is dan het, of als het werd onderworpen aan speciale en rigoureuze omstandigheden.
Clusters
Er zijn verbindingen waarbij elk Rb-atoom afzonderlijk oxidatiegetallen met fractionele waarden presenteert. Bijvoorbeeld in de Rb6O (Rb6twee+OFtwee-) en Rb9OFtwee (Rb94+OFtweetwee-) de positieve lading wordt verdeeld over een reeks Rb-atomen (clusters). Dus in de Rb6Of het oxidatiegetal zou in theorie +1/3 zijn; terwijl in de Rb9OFtwee, + 0,444 (4/9).
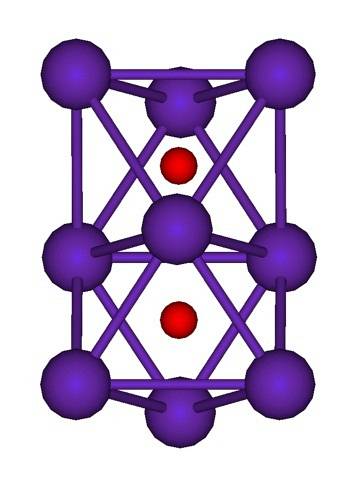
De clusterstructuur van Rb is hierboven weergegeven.9OFtwee vertegenwoordigd door een model van bollen en balken. Merk op hoe de negen Rb-atomen de O-anionen 'omsluiten'.twee-.
Ter verduidelijking: het is alsof een deel van de oorspronkelijke metallische rubidiumkristallen onveranderd bleef terwijl ze werden gescheiden van het moederkristal. Ze verliezen daarbij elektronen; die nodig zijn om de O aan te trekkentwee-, en de resulterende positieve lading wordt verdeeld over alle atomen van het cluster (set of aggregaten van Rb-atomen).
In deze rubidiumclusters kan het bestaan van Rb dus niet formeel worden aangenomen.+. De Rb6O en Rb9OFtwee Ze worden geclassificeerd als rubidiumsuboxiden, waarbij aan deze schijnbare anomalie van het hebben van een overmaat aan metaalatomen ten opzichte van de oxide-anionen wordt voldaan.
Waar te vinden en te verkrijgen
aardkorst

Rubidium is het 23e meest voorkomende element in de aardkorst, met een overvloed die vergelijkbaar is met die van de metalen zink, lood, cesium en koper. Het detail is dat zijn ionen wijdverspreid zijn, dus het overheerst in geen enkel mineraal als het belangrijkste metaalelement, en zijn ertsen zijn ook schaars..
Het is om deze reden dat rubidium een erg duur metaal is, zelfs meer dan goud zelf, aangezien het proces om uit zijn ertsen te winnen complex is vanwege de moeilijkheid van de exploitatie ervan..
Gezien zijn reactiviteit wordt rubidium in de natuur niet in zijn oorspronkelijke staat aangetroffen, maar als een oxide (RbtweeO), chloride (RbCl) of vergezeld van andere anionen. Zijn "vrije" ionen Rb+ worden aangetroffen in de zeeën met een concentratie van 125 µg / L, evenals in warmwaterbronnen en rivieren.
Onder de mineralen van de aardkorst die het in een concentratie van minder dan 1% bevatten, hebben we:
-Leucite, K [AlSitweeOF6
-Polucita, Cs (SitweeHallo6NHtweeOF
-Carnalite, KMgCl36HtweeOF
-Zinnwaldite, KLiFeAl (AlSi3)OF10(OH, F)twee
-Amazoniet, Pb, KAlSi3OF8
-Petalite, LiAlSi4OF10
-Biotiet, K (Mg, Fe)3AlSi3OF10(OH, F)twee
-Rubicline, (Rb, K) AlSi3OF8
-Lepidoliet, K (Li, Al)3(Ja, Al)4OF10(F, OH)twee
Geochemische vereniging
Al deze mineralen hebben een of twee dingen gemeen: het zijn kalium-, cesium- of lithiumsilicaten, of het zijn minerale zouten van deze metalen..
Dit betekent dat rubidium een sterke neiging heeft om te associëren met kalium en cesium; Het kan zelfs kalium vervangen tijdens de kristallisatie van mineralen of gesteenten, zoals gebeurt in de afzettingen van pegmatieten wanneer magma kristalliseert. Rubidium is dus een bijproduct van de exploitatie en raffinage van deze gesteenten en hun mineralen..
Rubidium is ook te vinden in gewone gesteenten zoals graniet, klei en basalt, en zelfs in steenkoolafzettingen. Van alle natuurlijke bronnen vertegenwoordigt lepidoliet het belangrijkste erts en wordt het commercieel geëxploiteerd..
In carnaliet daarentegen komt rubidium voor als RbCl-onzuiverheden met een gehalte van 0,035%. En in een hogere concentratie zijn er poluciet- en rubicline-afzettingen, die tot 17% rubidium kunnen bevatten..
Zijn geochemische associatie met kalium is te wijten aan de gelijkenis van hun ionstralen; de Rb+ is groter dan K+, maar het verschil in grootte is geen belemmering voor de eerste om de tweede in zijn minerale kristallen te kunnen vervangen.
Gefractioneerde kristallisatie
Of u nu begint met lepidoliet of poluciet, of met een van de bovengenoemde mineralen, de uitdaging blijft in meer of mindere mate hetzelfde: rubidium scheiden van kalium en cesium; dat wil zeggen: pas technieken voor het scheiden van mengsels toe die het mogelijk maken enerzijds rubidiumverbindingen of zouten te hebben en anderzijds die van kalium en cesium..
Dit is moeilijk omdat deze ionen (K+, Rb+ en Cs+) delen een grote chemische gelijkenis; Ze reageren op dezelfde manier om dezelfde zouten te vormen, die dankzij hun dichtheid en oplosbaarheid nauwelijks van elkaar verschillen. Daarom wordt gefractioneerde kristallisatie gebruikt, zodat ze langzaam en gecontroleerd kunnen kristalliseren..
Deze techniek wordt bijvoorbeeld gebruikt om een mengsel van carbonaten en aluin van deze metalen te scheiden. De herkristallisatieprocessen moeten verschillende keren worden herhaald om kristallen met grotere zuiverheid en vrij van gecoprecipiteerde ionen te garanderen; een rubidiumzout dat kristalliseert met K-ionen+ of Cs+ op het oppervlak of binnen.
Modernere technieken, zoals het gebruik van een ionenuitwisselingshars of kroonethers als complexvormers, maken ook de isolatie van Rb-ionen mogelijk.+.
Elektrolyse of reductie
Zodra het rubidiumzout is afgescheiden en gezuiverd, is de volgende en laatste stap het verminderen van de Rb-kationen+ naar massief metaal. Om dit te doen, wordt het zout gesmolten en aan elektrolyse onderworpen, zodat rubidium neerslaat op de kathode; of er wordt een sterk reductiemiddel gebruikt, zoals calcium en natrium, dat in staat is om snel elektronen te verliezen en aldus rubidium te verminderen.
Isotopen
Rubidium wordt op aarde gevonden als twee natuurlijke isotopen: de 85Rb en 87Rb. De eerste heeft een overvloed van 72,17%, terwijl de tweede van 27,83%.
De 87Rb is ervoor verantwoordelijk dat dit metaal radioactief is; de straling is echter onschadelijk en zelfs gunstig voor dateringsanalyse. Zijn halfwaardetijd (t1/2) is 4.91010 jaren, waarvan de tijdspanne de ouderdom van het heelal overschrijdt. Als het vervalt, wordt het de stabiele isotoop 87Dhr.
Dankzij dit is deze isotoop sinds het begin van de aarde gebruikt om de ouderdom van terrestrische mineralen en gesteenten te dateren..
Naast isotopen 85Rb en 87Rb, er zijn andere synthetische en radioactieve met variabele en veel kortere levensduur; Bijvoorbeeld hem 82Rb (t1/2= 76 seconden), 83Rb (t1/2= 86,2 dagen), 84Rb (t1/2= 32,9 dagen) en 86Rb (t1/2= 18,7 dagen). Van allemaal is de 82Rb wordt het meest gebruikt in medische studies.
Risico's
Metaal
Rubidium is zo'n reactief metaal dat het in glazen ampullen onder een inerte atmosfeer moet worden bewaard, zodat het niet reageert met zuurstof in de lucht. Als de blaar breekt, kan het metaal ter bescherming in kerosine of minerale olie worden gedaan; het zal echter uiteindelijk worden geoxideerd door de zuurstof die erin is opgelost, waardoor rubidiumperoxiden ontstaan.
Als daarentegen wordt besloten om het op hout te plaatsen, zal het uiteindelijk branden met een violette vlam. Als er veel vocht is, zal het verbranden door aan de lucht te worden blootgesteld. Wanneer een groot stuk rubidium in een hoeveelheid water wordt gegooid, explodeert het krachtig, waarbij zelfs het geproduceerde waterstofgas wordt ontstoken.
Daarom is rubidium een metaal dat niet iedereen zou moeten hanteren, aangezien praktisch al zijn reacties explosief zijn..
Ion
In tegenstelling tot metallisch rubidium, zijn Rb-ionen+ ze vormen geen duidelijk risico voor levende wezens. Deze opgelost in water werken op dezelfde manier met cellen in als K-ionen.+.
Daarom vertonen rubidium en kalium vergelijkbaar biochemisch gedrag; rubidium is echter geen essentieel element, terwijl kalium dat wel is. Op deze manier aanzienlijke hoeveelheden Rb+ kan zich ophopen in cellen, rode bloedcellen en ingewanden zonder het lichaam van een dier negatief te beïnvloeden.
In feite wordt geschat dat een volwassen mannetje met een massa van 80 kg ongeveer 37 mg rubidium bevat; en dat bovendien een verhoging van deze concentratie in de orde van grootte van 50 tot 100 keer niet tot ongewenste symptomen leidt.
Er is echter een overmaat aan Rb-ionen+ kan uiteindelijk de K-ionen verdringen+en dientengevolge zal het individu zeer sterke spierspasmen ondergaan tot aan de dood.
Het is duidelijk dat oplosbare rubidiumzouten of verbindingen dit onmiddellijk kunnen veroorzaken, dus ze mogen niet worden ingenomen. Bovendien kan het brandwonden veroorzaken door eenvoudig contact, en een van de meest giftige kunnen we de fluoride (RbF), hydroxide (RbOH) en cyanide (RbCN) van rubidium noemen..
Toepassingen
Gas verzamelaar
Rubidium is gebruikt om sporen van gassen op te vangen of te verwijderen die zich in vacuüm afgesloten buizen kunnen bevinden. Juist vanwege hun sterke neiging om zuurstof en vocht erin op te vangen, elimineren ze deze op hun oppervlak als peroxiden.
Pyrotechniek
Wanneer rubidiumzouten verbranden, geven ze een karakteristieke roodviolette vlam af. Sommige vuurwerken hebben deze zouten in hun samenstelling zodat ze exploderen met deze kleuren.
Supplement
Rubidiumchloride is voorgeschreven om depressie te bestrijden, omdat studies een tekort aan dit element hebben vastgesteld bij personen die aan deze medische aandoening lijden. Het is ook gebruikt als kalmerend middel en om epilepsie te behandelen.
Bose-Einstein-condensaat
Isotoop-atomen 87Rb werden gebruikt om het eerste Bose-Einstein-condensaat te maken. Deze toestand van materie bestaat erin dat de atomen bij een temperatuur die vrij dicht bij het absolute nulpunt (0 K) ligt, gegroepeerd of "gecondenseerd" zijn en zich gedragen alsof ze één zijn..
Rubidium was dus de hoofdrolspeler van deze triomf op het gebied van de natuurkunde, en het waren Eric Cornell, Carl Wieman en Wolfgang Ketterle die dankzij dit werk in 2001 de Nobelprijs ontvingen..
Tumor diagnose
De synthetische radio-isotoop 82Rb vervalt door positronen uit te zenden, die worden gebruikt om zich op te hopen in kaliumrijke weefsels; zoals die in de hersenen of het hart. Het wordt dus gebruikt om de functionaliteit van het hart en de aanwezigheid van mogelijke tumoren in de hersenen te analyseren door middel van een positronemissietomografie..
Component
Rubidiumionen hebben een plaats gevonden in verschillende soorten materialen of mengsels. Zijn legeringen zijn bijvoorbeeld gemaakt met goud, cesium, kwik, natrium en kalium. Het is toegevoegd aan glazen en keramiek, waarschijnlijk om hun smeltpunt te verhogen.
In zonnecellen zijn perovskieten toegevoegd als een belangrijk onderdeel. Evenzo is ook het mogelijke gebruik ervan als thermo-elektrische generator, warmteoverdrachtsmateriaal in de ruimte, brandstof in ionenvoortstuwingsmotoren, elektrolytisch medium voor alkalinebatterijen en in atomaire magnetometers bestudeerd..
Atoomklokken
Met rubidium en cesium zijn de beroemde zeer nauwkeurige atoomklokken vervaardigd, die bijvoorbeeld worden gebruikt in GPS-satellieten waarmee de bezitters van hun smartphones hun locatie kunnen weten terwijl ze zich op de weg verplaatsen..
Referenties
- Bond Tom. (29 oktober 2008). Rubidium. Hersteld van: chemistryworld.com
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Rubidium. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Rubidium. PubChem-database. CID = 5357696. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Chellan, P., en Sadler, P. J. (2015). De elementen van het leven en medicijnen. Filosofische transacties. Serie A, Wiskundige, fysische en technische wetenschappen, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Mayo Stichting voor Medisch Onderwijs en Onderzoek. (2019). Rubidium Rb 82 (intraveneuze route). Hersteld van: mayoclinic.org
- Markies Miguel. (s.f.). Rubidium. Hersteld van: nautilus.fis.uc.pt
- James L. Dye. (12 april 2019). Rubidium. Encyclopædia Britannica. Hersteld van: britannica.com
- Dr. Doug Stewart. (2019). Rubidium Element Feiten. Chemicool. Hersteld van: chemicool.com
- Michael Pilgaard. (10 mei 2017). Rubidium chemische reacties. Hersteld van: pilgaardelements.com



Niemand heeft nog op dit artikel gereageerd.