
Organische zouten eigenschappen, toepassingen en voorbeelden

De organische zouten ze zijn een dicht aantal ionische verbindingen met ontelbare kenmerken. Ze zijn eerder afgeleid van een organische verbinding, die een transformatie heeft ondergaan waardoor het een lading kan dragen, en ook is de chemische identiteit ervan afhankelijk van het bijbehorende ion.
Twee zeer algemene chemische formules voor organische zouten worden weergegeven in de onderstaande afbeelding. De eerste, R-AX, wordt geïnterpreteerd als een verbinding waarvan de koolstofstructuur een atoom, of groep A, een positieve + of negatieve lading (-) heeft..
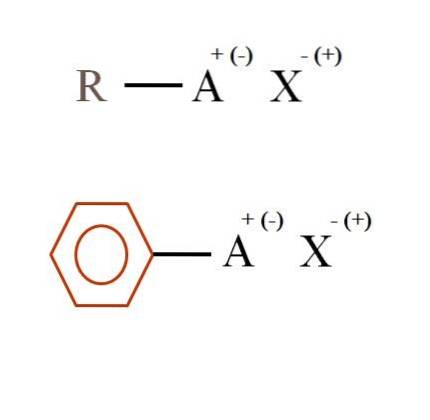
Zoals te zien is, is er een covalente binding tussen R en A, RA, maar op zijn beurt heeft A een formele lading die het ion X aantrekt (of afstoot). Het teken van de lading hangt af van de aard van A en de chemische omgeving.
Als A positief was, met hoeveel X's zou het dan kunnen communiceren? Met slechts één, gezien het principe van elektroneutraliteit (+ 1-1 = 0). Maar wat is de identiteit van X? Anion X zou CO kunnen zijn3twee-, waarvoor twee RA-kationen nodig zijn+een halogenide: F-, Cl-, Br-, enz.; of zelfs een andere RA-verbinding-. De opties zijn niet te overzien.
Ook kan een organisch zout een aromatisch karakter hebben, geïllustreerd door de bruine benzeenring. Het benzoaatzout van koper (II), (C.6H.5COO)tweeCu bestaat bijvoorbeeld uit twee aromatische ringen met negatief geladen carboxylgroepen, die een interactie aangaan met het Cu-kation.twee+.
Artikel index
- 1 Fysische en chemische eigenschappen
- 1.1 Hoge moleculaire massa's
- 1.2 Amfifiele stoffen en oppervlakteactieve stoffen
- 1.3 Hoog kook- of smeltpunt
- 1.4 zuurgraad en basiciteit
- 2 toepassingen
- 3 Voorbeelden van organische zouten
- 3.1 Carboxylaten
- 3.2 Lithiumdiakylcupraten
- 3.3 Sulfoniumzouten
- 3.4 Oxoniumzouten
- 3.5 Aminezouten
- 3.6 Diazoniumzouten
- 4 referenties
Fysische en chemische eigenschappen
Uit de afbeelding kan worden gezegd dat organische zouten uit drie componenten bestaan: de organische, R of Ar (de aromatische ring), een atoom of groep die de ionische lading A draagt, en een tegenion X.
Net zoals de identiteit en chemische structuur worden bepaald door dergelijke componenten, zijn hun eigenschappen er op dezelfde manier van afhankelijk..
Uit dit feit kunnen bepaalde algemene eigenschappen worden samengevat waaraan de overgrote meerderheid van deze zouten voldoet..
Hoge moleculaire massa's
Ervan uitgaande dat mono- of meerwaardige anorganische X-anionen zijn, hebben organische zouten de neiging om veel grotere molecuulgewichten te hebben dan anorganische zouten. Dit komt voornamelijk door het koolstofskelet, waarvan de enkele C-C-bindingen en hun waterstofatomen veel massa aan de verbinding bijdragen..
Daarom zijn R of Ar verantwoordelijk voor hun hoge moleculaire massa..
Amfifiele stoffen en oppervlakteactieve stoffen
Organische zouten zijn amfifiele verbindingen, dat wil zeggen dat hun structuren zowel hydrofiele als hydrofobe uiteinden hebben..
Wat zijn zulke uitersten? R of Ar vertegenwoordigen de extreem hydrofobe, omdat hun C- en H-atomen geen grote affiniteit hebben voor watermoleculen.
NAAR+, het ladingdragende atoom of de ladingdragende groep is het hydrofiele uiteinde, aangezien het bijdraagt aan het dipoolmoment en in wisselwerking staat met water, waarbij het dipolen vormt (RA+ Ohtwee.
Wanneer de hydrofiele en hydrofobe gebieden gepolariseerd zijn, wordt het amfifiele zout een oppervlakteactieve stof, een stof die veel wordt gebruikt voor de vervaardiging van wasmiddelen en demulgatoren.
Hoog kookpunt of smeltpunt
Net als anorganische zouten hebben organische zouten ook hoge smelt- en kookpunten, vanwege de elektrostatische krachten die de vloeibare of vaste fase beheersen..
Omdat er echter een organische component R of Ar is, nemen andere soorten Van der Waals-krachten deel (Londense krachten, dipool-dipool, waterstofbruggen) die op een bepaalde manier concurreren met elektrostatica..
Om deze reden zijn de vaste of vloeibare structuren van organische zouten in eerste instantie complexer en gevarieerder. Sommigen van hen kunnen zich zelfs zo gedragen vloeibare kristallen.
Zuurheid en basiciteit
Organische zouten zijn over het algemeen sterkere zuren of basen dan anorganische zouten. Dit komt omdat A, bijvoorbeeld in aminezouten, een positieve lading heeft vanwege zijn binding met een extra waterstof: A+-H. Doneer vervolgens, in contact met een basis, het proton om weer een neutrale verbinding te worden:
RA+H + B => RA + HB
De H hoort bij A, maar hij is geschreven omdat hij deelneemt aan de neutralisatiereactie.
Aan de andere kant, RA+ Het kan een groot molecuul zijn, niet in staat om vaste stoffen te vormen met een voldoende stabiel kristalrooster met het hydroxyl- of hydroxylanion OH-.
Wanneer dit zo is, wordt het RA-zout+Oh- gedraagt zich als een sterke basis; zelfs zo basisch als NaOH of KOH:
RA+Oh- + HCl => RACl + HtweeOF
Merk op in de chemische vergelijking dat het anion Cl- vervangt OH-, het vormen van het zout RA+Cl-.
Toepassingen
Het gebruik van organische zouten zal variëren naargelang de identiteit van R, Ar, A en X. Bovendien hangt hun toepassing ook af van het type vaste stof of vloeistof dat ze vormen. Enkele algemeenheden in dit verband zijn:
-Ze dienen als reagentia voor de synthese van andere organische verbindingen. RAX kan optreden als een "donor" voor de R-keten om toe te voegen aan een andere verbinding die een goede vertrekkende groep vervangt.
-Het zijn oppervlakteactieve stoffen, dus ze kunnen ook als smeermiddel worden gebruikt. Hiervoor worden metaalzouten van carboxylaten gebruikt.
-Ze maken het mogelijk om een breed scala aan kleurstoffen te synthetiseren.
Voorbeelden van organische zouten
Carboxylaten
Carbonzuren reageren met een hydroxide in een neutralisatiereactie, waarbij carboxylaatzouten ontstaan: RCOO- M.+waar M+ kan elk metaalkation zijn (Na+, Pbtwee+, K+, etc.) of het ammoniumkation NH4+.
Vetzuren zijn carbonzuren met een alifatische keten en kunnen zowel verzadigd als onverzadigd zijn. Onder de verzadigde zijn palmitinezuur (CH3(CHtwee14COOH). Hieruit komt het palmitaatzout voort, terwijl stearinezuur (CH3(CHtwee16COOH vormt het stearaatzout. Zepen zijn gemaakt van deze zouten.
In het geval van benzoëzuur, C.6H.5COOH (waarbij C6H.5- is een benzeenring), wanneer het reageert met een base, vormt het benzoaatzouten. In alle carboxylaten is de groep -COO- vertegenwoordigt A (RAX).
Lithium-diakylcupraten
Lithiumdiakylcupraat is nuttig bij organische synthese. De formule is [R-Cu-R]-Li+, waarin het koperatoom een negatieve lading draagt. Hier vertegenwoordigt het koper atoom A in de afbeelding.
Sulfoniumzouten
Ze worden gevormd door de reactie van een organisch sulfide met een alkylhalogenide:
RtweeS + R'X => RtweeR'S+X
Voor deze zouten draagt het zwavelatoom een positieve formele lading (S.+) door drie covalente bindingen te hebben.
Oxoniumzouten
Evenzo reageren ethers (de geoxygeneerde analogen van sulfiden) met hydraciden om oxoniumzouten te vormen:
ROR '+ HBr <=> RO+HR '+ Br-
Het zure proton van HBr is covalent gebonden aan het zuurstofatoom van de ether (R.tweeOF+-H), positief opladen.
Aminezouten
Aminen kunnen net als hun zouten primair, secundair, tertiair of quaternair zijn. Ze worden allemaal gekenmerkt doordat ze een H-atoom hebben gekoppeld aan het stikstofatoom.
Dus RNH3+X- is een primair aminezout; RtweeNHtwee+X-, secundair amine; R3NH+X-, tertiair amine; en R4N+X-, quaternair amine (quaternair ammoniumzout).
Diazoniumzouten
Ten slotte, diazoniumzouten (RNtwee+X-) of aryldiazonium (ArNtwee+X-), vertegenwoordigen het startpunt van veel organische verbindingen, vooral azokleurstoffen.
Referenties
- Francis A. Carey. Organische chemie. (Zesde editie, pagina's 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organische chemie. Amines. (10e editie.). Wiley plus.
- Wikipedia. (2018). Zout (chemie). Genomen uit: en.wikipedia.org
- Steven A. Hardinger. (2017). Geïllustreerde verklarende woordenlijst van organische chemie: zouten. Hersteld van: chem.ucla.edu
- Chevron Oronite. (2011). Carboxylaten. [Pdf]. Hersteld van: oronite.com



Niemand heeft nog op dit artikel gereageerd.