
IJzersulfaat (FeSO4) structuur, eigenschappen, synthese

De IJzersulfaat is een anorganisch zout waarvan de chemische formule FeSO is4. Het bestaat uit een kristallijne vaste stof met een variabele kleur, industrieel verkregen als bijproduct van de staalverwerking..
Het wordt in de natuur in verschillende vormen aangetroffen, waarvan de meest voorkomende ijzersulfaat-heptahydraat, FeSO, is47HtweeO ("groene vitriool", aanwezig in het mineraal melenteriet). Dit hydraat is gemakkelijk te onderscheiden door de blauwgroene kleur van de kristallen (onderste afbeelding). Andere hydraten hebben de algemene formule FeSO4XHtweeOf, waarbij x varieert van 1 tot 7.

Ferrosulfaat-heptahydraat verliest bij verhitting watermoleculen en kan worden omgezet in andere vormen van ferrosulfaat; bij verhitting tot 57 ºC verliest het dus drie watermoleculen en wordt het omgezet in ferrosulfaattetrahydraat. Hoeveel kunt u er in totaal verliezen? Zeven watermoleculen, dat wil zeggen teveel water.
IJzersulfaat wordt gebruikt bij de behandeling en preventie van bloedarmoede door ijzertekort. Het kan echter giftige effecten hebben, dus u moet voorzichtig zijn met de dosering.
Aan de andere kant heeft dit ijzerzout talloze toepassingen en toepassingen, waaronder het kleuren van textielmateriaal en leer; chemisch reductiemiddel; stralingsdosimeter; houtbeschermingsmiddel. Het wordt ook gebruikt bij het voorkomen van chlorose in planten en bij graveer- en lithografieprocessen..
Het FeSO4 kan oxideren in de lucht tot ijzer (III) sulfaat, Fetwee(ZW43 met een snelheid die kan worden verhoogd door temperatuur, licht of een stijging van de pH.
Veel van de fysische en chemische eigenschappen van ferrosulfaat, zoals oplosbaarheid in water, smeltpunt, het soort kristallen dat het vormt en dichtheid, hangen af van het aantal watermoleculen dat in de kristallen is opgenomen; dat wil zeggen, van zijn hydraten.
Artikel index
- 1 Structuur van ijzersulfaat
- 1.1 Zuurheid
- 2 Fysische en chemische eigenschappen
- 2.1 Namen
- 2.2 Moleculaire formule
- 2.3 Molecuulgewicht
- 2.4 Fysiek voorkomen
- 2.5 Geur
- 2.6 Dichtheid
- 2.7 Smeltpunt
- 2.8 Oplosbaarheid in water
- 2.9 Oplosbaarheid in alcohol
- 2.10 Dampspanning
- 2.11 Brekingsindex
- 2.12 Stabiliteit
- 2.13 Ontleding
- 2.14 Reacties
- 3 Synthese
- 3.1 Van staalwol
- 3.2 Van pyriet
- 4 Risico's
- 5 toepassingen
- 5.1 In de landbouw
- 5.2 Als reagens en in de industrie
- 5.3 In de geneeskunde en voor voedselverrijking
- 5.4 Andere
- 6 referenties
Structuur van ijzersulfaat
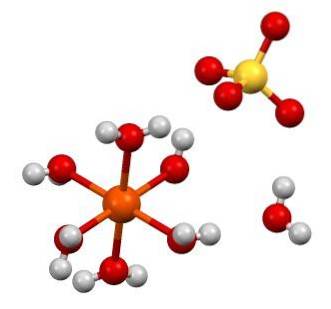
De chemische formule FeSO4 benadrukt dat dit zout is samengesteld uit Fe-ionentwee+ En dus4twee- in een verhouding van 1: 1. Beide ionen werken door middel van elektrostatische krachten op een zodanige manier samen dat ze zijn gerangschikt in een orthorhombisch kristalsysteem; wat logischerwijs overeenkomt met het watervrije zout.
In de bovenste afbeelding wordt daarentegen de structuur van FeSO getoond47HtweeO. De oranje bol stelt het Fe-kation voortwee+, die, zoals te zien is, coördineert met zes watermoleculen om een octaëder te vormen. De last van het gelooftwee+ trekt het SO-anion aan4twee-, en dit vormt op zijn beurt, indien waargenomen, een waterstofbinding met het zevende watermolecuul.
Het zevende watermolecuul (degene die ver verwijderd is van de octaëder) vormt ook een andere waterstofbinding met een ander watermolecuul dat tot een naburige octaëder behoort. Het resultaat van deze interacties is dat het kristal verandert van orthorhombisch naar monoklien..
Zoals de FeSO-kristallen4 watervrij hydraat, de anionen SO4twee- rond het gelooftwee+ worden vervangen door H-moleculentweeO. Deze substituties verstoren de elektronen d ijzer, waardoor ze gedwongen worden door verschillende energieniveaus te gaan; die verantwoordelijk zijn voor de kleurveranderingen tussen wit, blauwachtig groen.
Zuurgraad
Sommige SO-anionen4twee- ze kunnen geprotoneerd worden als een product van het zure medium. Als gevolg hiervan, binnen de FeSO-kristallen47HtweeOf er kunnen moleculen van H zijntweeSW4 als de pH erg zuur is; en daarom kan het aanraken van deze prachtige kristallen onder dergelijke omstandigheden ernstige brandwonden veroorzaken..
Fysische en chemische eigenschappen
Namen
IJzersulfaat of ijzer (II) sulfaat
Moleculaire formule
-Watervrij ijzersulfaat (FeSO4
-IJzersulfaat-heptahydraat (FeSO4.7HtweeOF)
Molecuulgewicht
Het varieert met de mate van hydratatie van het sulfaat. IJzersulfaat-heptahydraat heeft bijvoorbeeld een molecuulgewicht van 278,02 g / mol; terwijl de watervrije een molecuulgewicht heeft van 151,91 g / mol.
Fysiek uiterlijk
Het varieert ook met de mate van hydratatie. De watervrije vorm heeft bijvoorbeeld witte orthorhombische kristallen; terwijl in de heptahydro-vorm de kristallen monoklien blauw-groenachtig zijn.
Geur
Toilet
Dichtheid
Watervrij ferrosulfaat is de dichtste zoutvorm (3,65 g / cm3De heptahydraatvorm is daarentegen de minst dichte (1.895 g / cm3.
Smeltpunt
Evenzo varieert dit afhankelijk van de mate van hydratatie. De watervrije vorm heeft een smeltpunt van 680 ° C (1856 ° F, 973 K) en de heptahydraatvorm 60-64 ° C (140-147 ° F, 333-337 K).
Oplosbaarheid in water
-Monohydraatvorm: 44,69 g / 100 ml water (77 ºC)
-Heptahydraat vorm 51,35 g / 100 ml water (54 ºC).
Oplosbaarheid in alcohol
Onoplosbaar.
Dampdruk
1,95 kPa (heptahydraatvorm)
Brekingsindex
1591 (monohydraat) en 1471 (heptahydraat).
Stabiliteit
In de lucht kan het snel oxideren en wordt het bedekt met een geelbruine kleur, wat duidt op de aanwezigheid van het Fe-kation.3+. De oxidatiesnelheid wordt verhoogd door toevoeging van alkali of door blootstelling aan licht..
Ontleding
Bij verhitting tot ontbinding, geeft het giftige dampen van zwaveldioxide en zwaveltrioxide af, waardoor een roodachtig ijzeroxide als residu achterblijft..
Reacties
Het is een reductiemiddel dat inwerkt op salpeterzuur en het reduceert tot stikstofmonoxide. Evenzo reduceert het chloor tot chloride, en de giftige vormen van chroom die in cement aanwezig zijn tot chroom (III), met minder giftigheid.
Synthese
Van staalwol
IJzersulfaat wordt geproduceerd door staal (Fe) te laten reageren met zwavelzuur. Bij de beschreven methode wordt de volgende procedure gevolgd: het staal wordt gebruikt in de vorm van staalwol, dat vooraf is ontvet met aceton..
De staalwol wordt vervolgens in een glazen beker geplaatst en volledig bedekt met 30-40% zwavelzuur, waardoor zuurvertering gedurende enkele uren kan plaatsvinden; totdat de staalwol verdwijnt. Er kan meer staalwol worden toegevoegd en de procedure kan meerdere keren worden herhaald.
Eventueel gevormde groene kristallen worden opnieuw opgelost met water dat met zwavelzuur tot pH 1-2 is aangezuurd. Deze oplossing wordt op filtreerpapier gefiltreerd en de pH wordt aangepast door natriumcarbonaat toe te voegen. De oplossing wordt bewaard om het contact met zuurstof te vermijden en zo de oxidatie van Fe te ontmoedigentwee+ tot geloof3+
Vervolgens wordt het filtraat verdampt bij een temperatuur tussen 80-90 ºC. De procedure wordt uitgevoerd in Pietri-capsules die op een verwarmingsplaat worden geplaatst. Vervolgens worden de gevormde groene kristallen verzameld, die naar een exsiccator kunnen worden gebracht om hun uitdroging te voltooien..
Van pyriet
IJzersulfaat wordt ook geproduceerd door oxidatie van pyriet (FeStwee.
2 FeStwee + 7 Otwee + 2 uurtweeO => 2 FeSO4 + 2 uurtweeSW4
Risico's
Inademing van FeSO4 veroorzaakt irritatie aan de neus, keel en longen. Als u lichamelijk contact heeft met dit zout, kan dit huid- en oogirritatie veroorzaken; Bovendien kan langdurig contact met de laatste een bruinachtige vlek en oogletsel veroorzaken..
Herhaalde inname kan misselijkheid, braken, maagpijn, obstipatie en onregelmatige stoelgang veroorzaken..
Tekenen van ferrosulfaatvergiftiging zijn onder meer: zwarte of bloederige ontlasting; blauwachtige huid en nagels; veranderingen in het volume van de uitgescheiden urine; flauwvallen; droge mond of ogen; pijn op de borst; eten; ademhalingsproblemen.
Bovendien kunnen snelle en onregelmatige hartslag, verhoogde dorst en honger, ongebruikelijke bleekheid en kortademigheid optreden..
Veranderde coagulatie is een indicatie van ferrosulfaatvergiftiging, waarbij verlenging van trombine-, protrombine- en partiële tromboplastinetijden wordt waargenomen..
De studies die zijn uitgevoerd naar het effect van ferrosulfaat op geïsoleerde spieren van het hart van konijnen, lieten zien dat het een vermindering veroorzaakte van de maximale spanning ontwikkeld door de bestudeerde hartspieren, evenals de maximale snelheid van spanningsontwikkeling..
Toepassingen
In de landbouw
-Het wordt gebruikt als bestrijdingsmiddel om het snuiven van tarwe en het verval van fruitbomen tegen te gaan.
-Het wordt gebruikt bij de behandeling van chlorose, een ziekte die wordt gekenmerkt door de gelige kleur van de bladeren, veroorzaakt door de alkaliteit van de bodems..
-Ferrosulfaat regelt de alkaliteit en verlaagt de pH van bodems.
- Verwijdert mos en verzorgt het gazon.
Als reagens en in de industrie
Binnen het gebruik van FeSO4 als reagens en in de industrie zijn er de volgende:
-Analytisch reagens
-Grondstof voor het verkrijgen van ferriet en magnetisch ijzeroxide
-Ingrediënt voor de aanmaak van het anorganische blauwe pigment
-Salpeterzuur, chloor en chroomreducerend reagens
-Bij de vervaardiging van andere sulfaten
-Het wordt gebruikt in de baden van galvaniseren met ijzer
-Houtbeschermingsmiddel
-In aluminium etsen
-Kwalitatieve analyse van nitraten (bruingele test door oxidatie van Fetwee+
-Polymerisatiekatalysator
-Het wordt gebruikt als voorloper van de synthese van andere ijzers
-Het wordt industrieel gebruikt als vlekverbeteraar
-Bij de vervaardiging van ijzerkleurstof
-Bijtmiddel in wolkleuring
-Om esdoornhout een zilveren kleur te geven
-IJzerkatalysator in de Fenton-reactie
In de geneeskunde en voor voedselverrijking
Het wordt gebruikt bij de behandeling van bloedarmoede door ijzertekort, met een dosis van 150-300 mg ijzersulfaat, driemaal daags, wat een merkbare toename van de hemoglobineconcentratie in één week behandeling veroorzaakt..
Het is ook aanbevolen voor gebruik bij zwangere vrouwen als aanvulling op hun dieet. Ferrosulfaat is gebruikt als samentrekkend middel bij wondgenezing bij runderen..
Anderen
Het wordt gebruikt bij de behandeling van afvalwater door flocculatie en ook voor de verwijdering van fosfaat uit deze wateren. IJzersulfaat-heptahydraat wordt gebruikt bij de identificatie van de soorten schimmels.
Referenties
- CR Scientific. (s.f.). Laboratoriumbereiding van ferrosulfaat. Hersteld van: crscientific.com
- Werner H. Baur. (1964). Over de kristalchemie van zouthydraten. III. De bepaling van de kristalstructuur van FeSO4.7HtweeOf (melanteriet). Acta Cryst. doi.org/10.1107/S0365110X64003000
- PubChem. (2019). IJzersulfaat-heptahydraat. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Marks Lynn. (19 december 2014). Wat is ferrosulfaat (Feosol)? Elke gezondheid. Hersteld van: dailyhealth.com
- Wikipedia. (2019). IJzer (II) sulfaat. Hersteld van: en.wikipedia.org


Niemand heeft nog op dit artikel gereageerd.