
Plumbous oxide (PbO) formule, eigenschappen, risico's en toepassingen

De schietlood roest, Lood (II) oxide of loodmonoxide, is een chemische verbinding met de formule PbO. Het wordt gevonden in twee polymorfen: litharge en masicotiet. De structuur wordt geïllustreerd in figuur 1.
Terugkerend naar de samenstelling, is litharge het geoxideerde product van gesmolten lood dat is geroerd of verstoven om lucht op te nemen, vervolgens is afgekoeld en gemalen om het gele poeder te vormen..
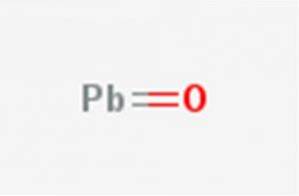
De naam masicotiet wordt zowel gebruikt voor het natuurlijke mineraal als voor het loodmonoxideproduct dat wordt geproduceerd door loodcarbonaat te verhitten tot 300ºC (loodmonoxide, 2016). Deze mineralen zijn weergegeven in figuur 2.

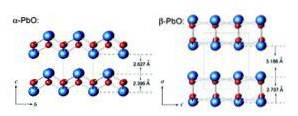
Masicotiet heeft een orthorhombische structuur, terwijl litharge een tetragonale kristalstructuur heeft. Lood (II) oxide heeft het vermogen om van structuur te veranderen bij verhitting of afkoeling. Deze structuren zijn weergegeven in figuur 3.
PbO wordt geproduceerd door metallisch lood te oxideren. Het metaal wordt gesmolten om loodtabletten te maken, en vervolgens worden ze gemalen tussen 170 ~ 210 ° C en door de vlam geleid voor oxidatie bij temperaturen boven 600 ℃. De oxideproducten worden vermalen om het afgewerkte loodoxide te verkrijgen (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO wordt op grote schaal geproduceerd als tussenproduct bij de raffinage van loodertsen tot metallisch lood. Het gebruikte loodmineraal is galena (lood (II) sulfide). Bij hoge temperatuur (1000 ° C) wordt het sulfide als volgt omgezet in oxide:
2PbS + 3O2 → 2PbO + 2SO2
Artikel index
- 1 Fysische en chemische eigenschappen van loodroest
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen van loodhoudend oxide
Loodmonoxide kan twee verschillende verschijningsvormen hebben: als een geel droog poeder met een orthorhombische structuur (masicotiet) of als roodachtige tetragonale kristallen (groot). Beide manieren worden geïllustreerd in figuur 4.

De verbinding heeft een molecuulgewicht van 223,20 g / mol en een dichtheid van 9,53 g / ml. Het heeft een smeltpunt van 888 ° C en een kookpunt van 1470 ° C (National Center for Biotechnology Information, S.F.).
De verbinding is zeer slecht oplosbaar in water en lost slechts 0,0504 gram per liter bij 25 ° C op in de vorm van masicotiet en 0,1065 gram per liter bij 25 ° C in de vorm van litharge. De verbinding is ook onoplosbaar in alcohol. Het is oplosbaar in azijnzuur, verdunde HNO3 en basen (Royal Society of Chemistry, 2015).
De verbinding is een zwak oxiderend of reductiemiddel, maar er kunnen nog steeds redoxreacties optreden. Deze verbindingen zijn niet reactief met water.
Loodoxide oxideert aluminiumcarbide met gloeien bij verhitting. Mengsels van loodoxide met aluminiumstof (zoals bij andere metalen: natrium, zirkonium) geven een heftige explosie.
Reactiviteit en gevaren
Loodmonoxide is een stof die als giftig is geclassificeerd. De stof is giftig voor het centrale zenuwstelsel en kan kankerverwekkend zijn bij mensen (Material Safety Data Sheet Lead oxide, yellow, 2013).
Het vroege vergiftigingssymptoom zijn loodlijnen die op de rand van het tandvlees verschijnen en de huid grijs wordt. Neurasthenisch syndroom zal ook optreden in de eerste periode van vernauwing..
Cerebellaire vergiftiging kan leiden tot depressie van loodvergiftiging, manie van loodvergiftiging, evenals loodtoxiciteit en gevoeligheid voor verlamming van meerdere neuritis.
Loodvergiftiging kan ook hypochrome anemie en endocriene en stofwisselingsstoornissen veroorzaken. Bovendien kan loodvergiftiging de activiteit van bepaalde enzymen in het spijsverteringsstelsel remmen en indigestie, ernstige buikpijn en leverschade veroorzaken. Het kan ook een hoge bloeddruk en een verhoogd cholesterol veroorzaken..
Als er hevige buikpijn is, kunnen enkele maatregelen worden genomen, zoals onderhuidse injectie van atropine en andere medicijnen, hete buik, klysma, heet bad enzovoort. De maximaal toegestane concentratie in de lucht is 0,01 mg / m3 (loodmonoxide, 2016).
In geval van contact met de ogen of met de huid, moet deze met veel water worden gewassen. In geval van inademing of inslikken, moet het slachtoffer naar een geventileerde plaats worden gebracht. Braken mag niet worden opgewekt. Als het slachtoffer niet ademt, moet mond-op-mondbeademing worden gegeven.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen. Loodmonoxide is een schadelijke stof voor het milieu, de bioaccumulatie van deze chemische stof kan voorkomen in planten en zoogdieren.
Het wordt sterk aanbevolen dat deze stof niet in het milieu terechtkomt, dus het moet worden gehanteerd en opgeslagen volgens de vastgestelde bepalingen (National Institute for Occupational Safety and Health, 2015).
Toepassingen
Loodmonoxide is gebruikt als verfdroger en als een lage vuurstroom bij de productie van keramiek en glas. Loodkristalglas wordt gebruikt bij de vervaardiging van serviesgoed van hoge kwaliteit.
Door loodmonoxide als flux te gebruiken, is het mogelijk om een glas te verkrijgen met een hoge brekingsindex en daarmee de gewenste helderheid (British Encyclopedia, 2016).
Semi-metalen keramische geleiders hebben de hoogste geleidbaarheden van alle keramiek behalve supergeleidende. Loodoxide is een voorbeeld van dit type halfmetaal keramiek. Deze materialen hebben overlappende elektronenenergiebanden en zijn daarom uitstekende elektronische geleiders (Mason, 2008).
Loodoxide wordt voornamelijk gebruikt in elektronenbuizen, beeldbuizen, optisch glas, röntgenwerend loodglas en stralingsbestendige rubbers..
Het wordt gebruikt als analytisch reagens, de silicaatstroom, maar ook voor het neerslaan van aminozuren
Loodoxide wordt gebruikt bij de vervaardiging van PVC-plastic stabilisator en is ook de grondstof voor andere loodzouten. Het wordt ook gebruikt bij de raffinage van aardolie en voor de bepaling van goud en zilver..
Het wordt ook gebruikt als geel pigment in verven en email. Masicotiet werd door kunstenaars uit de 15e tot 18e eeuw als pigment gebruikt.
Dunne lagen loodmonoxide worden gebruikt om iriserende kleuren in messing en brons te produceren. Litharge wordt gemengd met glycerol om loodgieterscement te maken.
Referenties
- Encyclopedia Britannica. (2016, 10 oktober). Glas. Opgehaald van britannica: britannica.com.
- Kirk-Othmer. (negentienvijfennegentig). Encyclopedie van chemische technologie. 4e druk. Volumes 1. New York: John Wiley and Sons.
- Loodmonoxide. (2016, 1 mei). Hersteld van cameo.mfa: cameo.mfa.org.
- Loodmonoxide. (2016). Opgehaald van chemicalbook: chemicalbook.com.
- Mason, T. O. (2008, 12 maart). Geleidende keramiek. Opgehaald van britannica: britannica.com.
- Veiligheidsinformatieblad Loodoxide, geel. (2013, 21 mei). Opgehaald van sciencelab: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem samengestelde database; CID = 14827. Opgehaald van PubChem: pubchem.ncbi.nlm.nih.gov.
- Nationaal instituut voor veiligheid en gezondheid op het werk. (2015, 22 juli). LOOD (II) OXIDE. Hersteld van cdc.gov: cdc.gov.
- Royal Society of Chemistry. (2015). Lood (II) oxide. Opgehaald van chemspider: chemspider.com.
Niemand heeft nog op dit artikel gereageerd.